Kredit:Wiley
Indoler, och strukturer som härrör från dem, är en del av många naturliga ämnen, såsom aminosyran tryptofan. En ny katalytisk reaktion producerar cyklopenta[b]-indoler – ramverk gjorda av tre ringar som är sammanfogade vid kanterna – mycket selektivt och med den önskade rumsliga strukturen. Som ett forskargrupp rapporterar i tidskriften Angewandte Chemie , hastigheterna för de olika stegen i reaktionen spelar en avgörande roll.
Indolderivat är vitt spridda i naturen; de är en del av serotonin och melatonin, såväl som många alkaloider - av vilka några används som droger, till exempel, som behandlingar för Parkinsons sjukdom. Indol är en aromatisk sexledad ring smält till en femledad ring längs ena kanten. Den femledade ringen har en dubbelbindning och en kväveatom. Den grundläggande indolramen kan utrustas med en mängd olika sidogrupper eller bindas till ytterligare ringar. Indol och många indolderivat kan framställas genom en indolsyntesreaktion utvecklad av och uppkallad efter Emil Fischer (syraassisterad kondensation av ketoner med fenylhydraziner).
Den viktigaste klassen av indolderivat är cyklopentan[b]indoler – molekyler med ett ramverk gjord av en indolenhet och en ytterligare femledad ring. Denna femledade ring kan innehålla ett kiralt kolcentrum, som är ett ringkol som har ytterligare två sidogrupper, och det kan arrangeras på två sätt som är spegelbilder av varandra. Endast en av de två enantiomererna, eller spegelbilder, finns i naturen. Dock, den klassiska Fischer -indolsyntesen ger en blandning av båda enantiomererna.
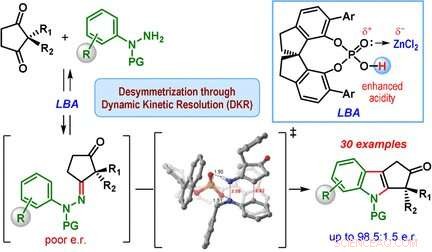
Ett team som leds av Santanu Mukherjee och Garima Jindal vid Indian Institute of Science, Bangalore (Indien) har nu utvecklat en katalytisk version av Fischer-indolsyntesen som primärt producerar en av enantiomererna (dvs. reaktionen är enantioselektiv). Utgångsmaterialen är en klass av diketoner (2, 2-disubstituerad cyklopentan-1, 3-dioner) och fenylhydrazinderivat utrustade med speciella skyddsgrupper. Hemligheten bakom deras framgång är en speciell katalysator:en kiral, cyklisk fosforsyra. Reaktionen utförs i närvaro av zinkklorid som samkatalysator och ett surt katjonbytarharts, som fångar upp ammoniaken som bildas som en biprodukt.
Hjärtat i reaktionsmekanismen kallas en dynamisk kinetisk upplösning. Under reaktionen, ett kiralt hydrazon bildas först som en mellanprodukt i båda enantiomera formerna. Detta steg är reversibelt, så att båda de enantiomera hydrazonerna kan interkonvertera under reaktionens gång. Reaktionen mellan hydrazonerna för att göra indolderivaten är den faktiska katalytiska reaktionen. Denna reaktion är mycket snabbare för en av hydrazonenantiomererna jämfört med den andra eftersom en form har en mer gynnsam geometri när den binder till den kirala katalysatorn. Den andra hydrazonenantiomeren reagerar mycket långsamt och leder till endast en liten mängd av indolprodukten. Istället, den långsamt reagerande hydrazonenantiomeren omvandlas till den snabbreagerande hydrazonenantiomeren, vilket gör att jämvikten så småningom skiftar till produkten cyklopentan[b]indol.
Denna metod gjorde det möjligt för teamet att producera många olika indolderivat med måttlig avkastning, men med bra till utmärkt enantiomer selektivitet.