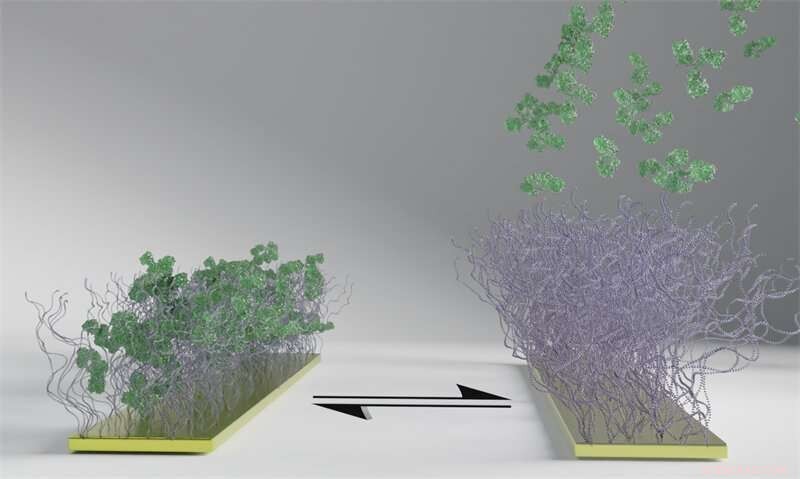
Polymerytan, sedd som penslar i bilden, reagerar på en elektrisk puls genom att ändra tillstånd från att fånga till att släppa de gröna biomolekylerna. Polymerytan fångar först biomolekylerna (vänster), och när elektriciteten slås på släpper de ut dem (höger). Till skillnad från biomolekylerna förblir polymerborstarna fästa trots den elektriska pulsen, och processen kan upprepas. Kredit:Chalmers tekniska högskola
Biomediciner produceras av levande celler och används för att behandla bland annat cancer och autoimmuna sjukdomar. En utmaning är att läkemedlen är mycket dyra att tillverka, något som begränsar den globala tillgången. Nu har forskare från Chalmers uppfunnit ett material som använder elektriska signaler för att fånga och frigöra biomolekyler. Den nya och effektiva metoden kan få stor betydelse för utvecklingen av biomediciner och bana väg för utvecklingen av elektroniska piller och läkemedelsimplantat.
Det nya materialet är en polymeryta som vid en elektrisk puls ändrar tillstånd från att fånga in till att frigöra biomolekyler. Detta har flera möjliga tillämpningar, inklusive användning som ett verktyg för effektiv separation av ett läkemedel från de andra biomolekyler som celler skapar vid produktion av biologiska läkemedel. Resultaten av studien publicerades nyligen i den vetenskapliga tidskriften Angewandte Chemie .
Biomediciner är mycket dyra att tillverka på grund av bristen på en effektiv separationsteknik, och nya tekniker med högre läkemedelsutbyte krävs för att minska produktionskostnaderna och i slutändan kostnaden för att behandla patienter.
"Våra polymerytor erbjuder ett nytt sätt att separera proteiner genom att använda elektriska signaler för att kontrollera hur de binds till och frigörs från en yta, samtidigt som de inte påverkar proteinets struktur", säger Gustav Ferrand-Drake del Castillo, som offentligt försvarade sin doktorsavhandling i kemi vid Chalmers och är huvudförfattare till studien.
Den konventionella separationstekniken – kromatografi – binder biomolekyler tätt till ytan och det krävs starka kemikalier för att få dem att släppa, vilket leder till förluster och dåligt utbyte. Många nya läkemedel har visat sig vara mycket känsliga för starka kemikalier, vilket skapar ett stort produktionsproblem för nästa generations biomediciner. Den lägre förbrukningen av kemikalier ger en fördel för miljön, samtidigt som det faktum att ytorna på det nya materialet också kan återanvändas genom flera cykler är en nyckelegenskap. Processen kan upprepas hundratals gånger utan att påverka ytan.
Funktioner i biologiska vätskor
Materialet fungerar även i biologiska vätskor med buffrande kapacitet, det vill säga vätskor med förmåga att motverka förändringar i pH-värdet. Denna egenskap är anmärkningsvärd eftersom den banar väg för skapandet av en ny teknik för implantat och elektroniska "piller" som släpper ut medicinen i kroppen via elektronisk aktivering.
"Du kan föreställa dig en läkare eller ett datorprogram som mäter behovet av en ny dos medicin hos en patient och en fjärrstyrd signal som aktiverar frisättningen av läkemedlet från implantatet som finns i just den vävnad eller organ där det behövs. ," säger Gustav Ferrand-Drake del Castillo.
Lokal, aktiverad läkemedelsfrisättning finns idag i form av material som ändrar tillstånd vid en förändring i den omgivande kemiska miljön. Till exempel tillverkas tabletter av pH-känsligt material där man vill kontrollera frisättningen av ett läkemedel i mag-tarmkanalen, vilket är en miljö med naturliga variationer i pH-värde. Men i de flesta av kroppens vävnader finns inga förändringar i pH-värde eller andra kemiska parametrar.
"Att kunna kontrollera frisättningen och upptaget av proteiner i kroppen med minimala kirurgiska ingrepp och utan nålinjektioner är, anser vi, en unik och användbar egenskap. Utvecklingen av elektroniska implantat är bara en av flera tänkbara tillämpningar som är många år in i framtiden. Forskning som hjälper oss att koppla elektronik med biologi på molekylär nivå är en viktig pusselbit i en sådan riktning, säger Gustav Ferrand-Drake del Castillo.
En annan fördel med den nya metoden är att den inte kräver stora mängder energi. Den låga strömförbrukningen beror på att polymerens djup på elektrodens yta är mycket tunt, på nanometerskalan, vilket gör att ytan reagerar direkt på små elektrokemiska signaler.
"Elektronik i biologiska miljöer begränsas ofta av storleken på batteriet och de rörliga mekaniska delarna. Aktivering på molekylär nivå minskar både energibehovet och behovet av rörliga delar", säger Gustav Ferrand-Drake del Castillo.
Genombrottet började som en doktorsavhandling
Forskningen bakom tekniken bedrivs under perioden då Ferrand-Drake del Castillo var doktorand i Chalmersprofessorn Andreas Dahlins forskargrupp vid avdelningen för tillämpad ytkemi. Projektet involverade polymerytor som växlar tillstånd mellan att vara neutrala och laddade beroende på pH-värdet i den omgivande lösningen. Forskarna lyckades sedan skapa ett material som var tillräckligt starkt för att stanna på ytan när det utsätts för upprepade elektriska signaler, samtidigt som det var tillräckligt tunt för att faktiskt ändra pH-värdet till följd av elektrokemin på ytan.
"Kort därefter upptäckte vi att vi kunde använda de elektriska signalerna för att kontrollera bindningen och frisättningen av proteiner och biomolekyler, och att elektrodmaterialet fungerar i biologiska lösningar som serum och centrifugerat blod. Vi tror och hoppas att våra upptäckter kan vara av stor betydelse. nytta i utvecklingen av nya läkemedel, säger Andreas Dahlin. + Utforska vidare