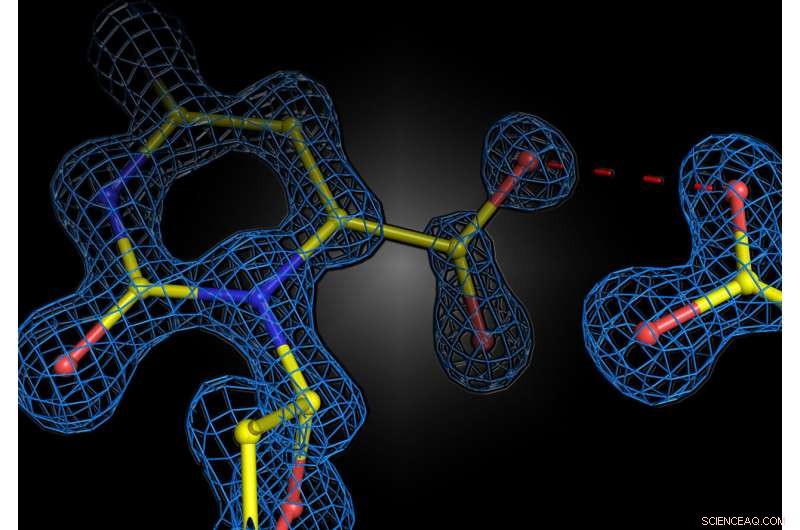
Strukturell ögonblicksbild av enzymreaktionen i det humana enzymet orotidin 5'-fosfatdekarboxylas. De två negativa laddningarna av substratet och enzymet stöter inte bort varandra, utan bildar en attraktiv interaktion. Kredit:Kai Tittmann
Det är välkänt inom fysik och kemi att lika laddningar stöter bort varandra, medan motsatta laddningar attraherar. Det antogs länge att denna princip gäller även när enzymer – de biologiska katalysatorerna i alla levande organismer – bildar eller bryter kemiska bindningar. Man trodde att enzymer placerar laddningar i sina "aktiva centra", där de kemiska reaktionerna faktiskt äger rum, på ett sådant sätt att de stöter bort liknande laddningar från de andra molekylerna runt dem. Detta koncept är känt som "elektrostatisk stress." Till exempel, om substratet (substansen som enzymet verkar på) har en negativ laddning, kan enzymet använda en negativ laddning för att "stressa" substratet och på så sätt underlätta reaktionen. En ny studie från universitetet i Göttingen och Max Planck-institutet för multidisciplinära vetenskaper i Göttingen har dock nu visat att två lika stora laddningar mot förmodan inte nödvändigtvis leder till avstötning, utan kan orsaka attraktion i enzymer. Resultaten publicerades i tidskriften Nature Catalysis .
Teamet undersökte ett välkänt enzym som har studerats omfattande och är ett läroboksexempel på enzymkatalys. Utan enzymet är reaktionen extremt långsam:i själva verket skulle det ta 78 miljoner år för hälften av substratet att reagera. Enzymet accelererar denna reaktion med 10 17 gånger, helt enkelt genom att placera negativa och positiva laddningar i det aktiva centret. Eftersom substratet innehåller en negativt laddad grupp som spjälkas av som koldioxid, antogs i årtionden att enzymets negativa laddningar tjänar till att stressa substratet, som också är negativt laddat, och påskynda reaktionen. Denna hypotetiska mekanism förblev dock obevisad eftersom reaktionens struktur var för snabb för att kunna observeras.
Professor Kai Tittmanns grupp vid Göttingen Center for Molecular Biosciences (GZMB) har nu för första gången lyckats använda proteinkristallografi för att få en strukturell ögonblicksbild av substratet strax före den kemiska reaktionen. Oväntat stötte inte de negativa laddningarna av enzym och substrat bort varandra. Istället delade de en proton, som fungerade som ett slags molekylärt lim i en attraktiv interaktion. "Frågan om två lika laddningar är vänner eller fiender i samband med enzymkatalys har länge varit kontroversiell inom vårt område, och vår studie visar att de grundläggande principerna för hur enzymer fungerar fortfarande är långt ifrån att förstås", säger Tittmann . De kristallografiska strukturerna analyserades av kvantkemisten professor Ricardo Mata och hans team från Göttingens universitets institut för fysikalisk kemi. "Den extra protonen, som har en positiv laddning, mellan de två negativa laddningarna används inte bara för att attrahera molekylen som är involverad i reaktionen, utan den utlöser en kaskad av protonöverföringsreaktioner som ytterligare accelererar reaktionen," förklarar Mata.
"Vi tror att dessa nybeskrivna principer för enzymkatalys kommer att hjälpa till i utvecklingen av nya kemiska katalysatorer", säger Tittmann. "Eftersom enzymet vi studerade frigör koldioxid, den viktigaste växthusgasen som produceras av mänskliga aktiviteter, kan våra resultat hjälpa till att utveckla nya kemiska strategier för koldioxidfixering." + Utforska vidare