Från Parkinsons och Alzheimers till hjärtrytmrubbningar är amyloider kopplade till ett antal sjukdomar. Dessa aggregat av proteiner bildas i kroppen när ett protein förlorar sin normala struktur och felveckas eller muterar. Och eftersom många av dessa proteiner är stora och komplicerade, förblir det ett mysterium hur några av dessa mutationer uppstår och aggregeras – liksom skapandet av effektiva behandlingar.
Ny forskning om glaukom ledd av kemister från Georgia Tech och en alumn kan hjälpa till att ändra på det.
"Det har gjorts mycket arbete för att förstå hur mindre veckade proteiner bildar amyloidaggregat, men den här studien hjälper oss att förstå aggregationsvägen för ett större, mer komplext system", säger medförfattaren Emily Saccuzzo. Det arbetet skulle en dag kunna hjälpa forskare att upptäcka nya behandlingsmetoder – inte bara för glaukom, utan även för andra sjukdomar orsakade av proteinaggregation.
Saccuzzo startade projektet 2018 som doktorand i Lieberman Lab vid School of Chemistry and Biochemistry vid Georgia Tech och är nu postdoktor vid Pacific Northwest National Labs.
"Emily var sommarstudent innan hon tog studenten, och hon etablerade den första genomförbarheten av att göra dessa experiment", säger Raquel Lieberman, professor och Sepcic Pfeil-ordförande i kemi vid Georgia Tech. "Jag är oerhört stolt över henne."
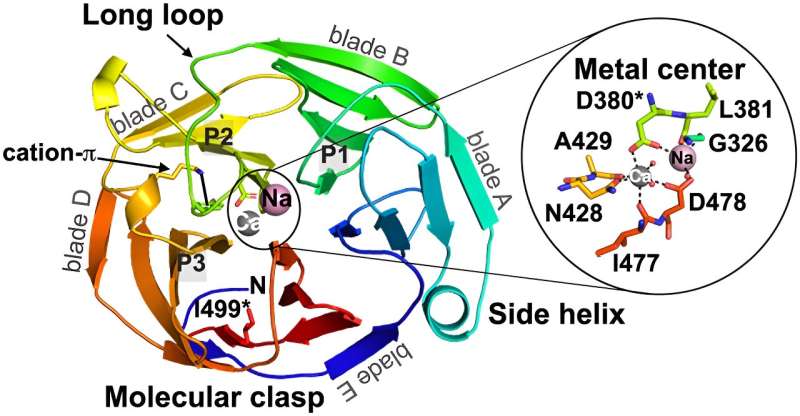
Deras forskarlags senaste resultat presenteras i en artikel, "Konkurrens mellan in-ut-utveckling och patogen aggregation i en amyloidbildande β-propeller", publicerad i tidskriften Nature Communications .
Lieberman och Saccuzzo samlade forskare från hela och utanför institutet för att samarbeta i studien.
"Detta var ett mycket tvärvetenskapligt projekt, och det är alltid riktigt tillfredsställande", säger Lieberman. "Jag tror att när du tar med fler människor till bordet kan du svara på svåra frågor och göra mer än du kan göra på egen hand."
Medan många studier har fokuserat på mindre proteiner, kallade modellproteiner, som har etablerat "regler" och kända mönster för amyloidbildning (en specialiserad typ av proteinaggregation), är proteinet som bidrar till glaukom större och mer komplext. Denna typ av större, komplicerat protein är relativt outstuderat.
"Vi hade vetat ett tag att mutationer i myocilin kan göra att proteinet felveckas och aggregeras, vilket i sin tur leder till glaukom", säger Saccuzzo. "Vad vi dock inte visste var den exakta mekanismen genom vilken detta protein felveckas och aggregeras.
"Målet med den här studien var att fastställa hur sjukdomsmutanter felveckas, i hopp om att det skulle ge oss insikt i de tidiga stegen i aggregationsvägen", tillägger hon.
Beläget i gränsytan mellan ögats vita och färgade iris, bildar proteinet en liten liten ring hela vägen runt ögat.
"Varje gång du blinkar sträcker du ut den muskeln. Varje gång det blåser riktigt starkt, eller du får något i ögat. Varje gång du gnuggar ögat kan du påverka detta protein - även när det inte orsakar sjukdom," Lieberman säger.
Fortfarande är forskarna inte säkra på vad proteinet gör. "Vi vet bara vad den gör när den orsakar problem", som glaukom, förklarar hon. "Vi vet inte vad dess faktiska biologiska funktion är."
Lieberman lockades till en början av idén att studera proteinet eftersom hon undrade om forskningen på modellproteinerna kunde vara tillämplig på det protein som orsakar glaukom.
"De riktigt tidiga studierna visade att det sannolikt liknade dessa modellproteiner som bildar amyloid," säger Lieberman. "Jag ville undersöka det för om vi kunde visa att det var sant, då skulle vi kunna utnyttja de fantastiska resurserna och forskningen som gjorts på modellsystem för att hjälpa oss att bekämpa sjukdomen."
"Detta var ett av de största amyloidbildande proteinerna som karaktäriserats hittills," säger Saccuzzo, och medan teamet hoppades att de skulle hitta likheter med modellproteiner, visade det större glaukomassocierade proteinet ökad komplexitet.
"Jag tror att en av de mest överraskande observationerna som vi gjort är att proteinet i sig inte är i jämvikt i cirka 90 dagar efter att det gjorts," tillägger Lieberman. "En av principerna för proteinkemin är att aminosyrasekvenser antar en unik struktur och att all information som behövs för att vika proteinet till dess 3D-struktur finns i den aminosyrasekvensen."
Här skummade proteinet en liten mängd, vilket betyder att det inte var i jämvikt. "Det händer så mycket mer i systemet än någon kunde ha föreställt sig", förklarar Lieberman. "Vi antar att formen styr några av egenskaperna, men detta är ett annat mysterium med detta protein."
Eftersom proteinet är så komplicerat och inte är i jämvikt, "finns det en lång lista över saker som vi inte kan förutsäga", säger Lieberman och tillägger att det gör datorförutsägelser svåra, tillsammans med vissa experiment. "Det var ett ögonblick då vi tänkte:wow, här är det här nya systemet som folk borde tänka på. Reglerna kan förfinas för att hjälpa oss att bättre förstå vad som händer."
Medan ytterligare forskning kommer att behöva utföras för att avgöra hur man bäst behandlar glaukom, ger studien en kritisk grund för framtida studier. "Vad som inte är klart för mig just nu är om vi skulle kunna hitta ett läkemedel för alla människor som har mutationer, eller om vi behöver ett specifikt läkemedel för varje typ av mutation som vi skulle stöta på", säger Lieberman. P>
Även om forskningen inte bevisar att en behandling kanske inte är effektiv för alla, "visar den verkligen att det finns mycket mer i det här systemet än vi någonsin förväntat oss."
"Att förstå hur sjukdomsmutanter ser ut på molekylär nivå kan hjälpa till att bana väg för strukturellt specifika glaukomterapier och diagnostiska verktyg," tillägger Saccuzzo.
Lieberman och Saccuzzo understryker också att arbetet som gjorts för att förstå det protein som är ansvarigt för glaukom också kan tillämpas på andra stora proteiner.
"I slutet av dagen är fler proteiner inte modellproteiner än modellproteiner", säger Lieberman.
"Det finns många fler system där ute, och jag misstänker att det finns många fler proteiner som kan aggregera och kan bidra till sjukdom eller åldrande som ännu inte har undersökts. Jag tror att den här forskningen visar värdet av att ta med många olika metoder för sondering. ett komplicerat system för att lära dig mer om det."
Mer information: Emily G. Saccuzzo et al., Konkurrens mellan in-ut-utveckling och patogen aggregation i en amyloidbildande β-propeller, Nature Communications (2024). DOI:10.1038/s41467-023-44479-2
Journalinformation: Nature Communications
Tillhandahålls av Georgia Institute of Technology