MYC är det formlösa proteinet som är ansvarigt för att göra majoriteten av mänskliga cancerfall värre. UC Riverside-forskare har hittat ett sätt att tygla det, och ger hopp om en ny era av behandlingar.
I friska celler hjälper MYC till att styra transkriptionsprocessen, där genetisk information omvandlas från DNA till RNA och så småningom till proteiner. "Normalt är MYC:s aktivitet strikt kontrollerad. I cancerceller blir den hyperaktiv och regleras inte ordentligt", säger UCRs docent i kemi Min Xue.
"MYC är mindre som mat för cancerceller och mer som en steroid som främjar cancers snabba tillväxt," sa Xue. "Det är därför MYC är en boven i 75 % av alla cancerfall hos människor."
I början av detta projekt trodde UCR:s forskargrupp att om de kunde dämpa MYC:s hyperaktivitet kunde de öppna ett fönster där cancern kunde kontrolleras.
Men att hitta ett sätt att kontrollera MYC var utmanande eftersom till skillnad från de flesta andra proteiner har MYC ingen struktur. "Det är i grunden en glob av slumpmässighet," sa Xue. "Konventionella pipelines för upptäckt av läkemedel förlitar sig på väldefinierade strukturer, och detta finns inte för MYC."
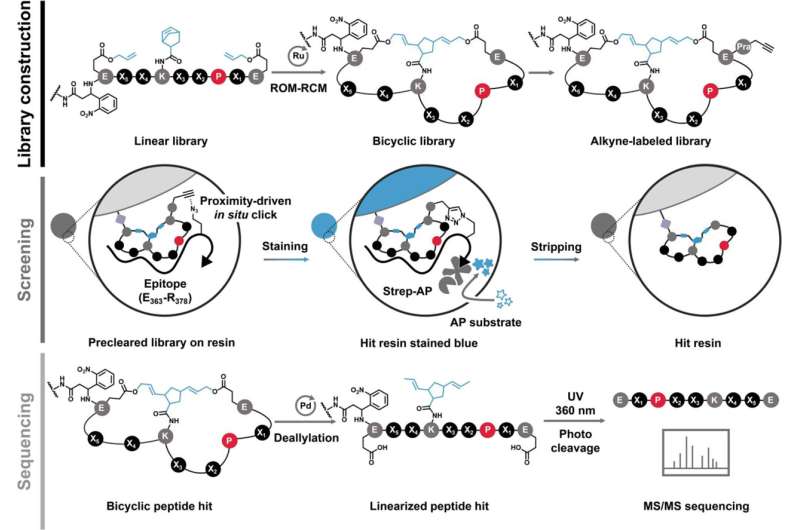
En ny artikel i Journal of the American Chemical Society , där Xue är senior författare, beskriver en peptidförening som binder till MYC och undertrycker dess aktivitet.
Under 2018 märkte forskarna att förändring av styvheten och formen på en peptid förbättrar dess förmåga att interagera med strukturlösa proteinmål som MYC.
"Peptider kan anta en mängd olika former, former och positioner," sa Xue. "När du väl böjer och kopplar dem till ringar kan de inte anta andra möjliga former, så de har då en låg nivå av slumpmässighet. Detta hjälper till med bindningen."
I uppsatsen beskriver teamet en ny peptid som binder direkt till MYC med vad som kallas sub-mikro-molär affinitet, som närmar sig styrkan hos en antikropp. Det är med andra ord en mycket stark och specifik interaktion.
"Vi förbättrade bindningsprestandan för denna peptid jämfört med tidigare versioner med två storleksordningar," sa Xue. "Detta gör det närmare våra mål för läkemedelsutveckling."
För närvarande använder forskarna lipidnanopartiklar för att leverera peptiden till celler. Dessa är små sfärer gjorda av fettmolekyler, och de är inte idealiska för användning som läkemedel. Framöver utvecklar forskarna kemi som förbättrar ledande peptidens förmåga att ta sig in i celler.
När peptiden väl är i cellen kommer den att binda till MYC, vilket förändrar MYC:s fysiska egenskaper och hindrar den från att utföra transkriptionsaktiviteter.
Xues laboratorium vid UC Riverside utvecklar molekylära verktyg för att bättre förstå biologi och använder den kunskapen för att utföra läkemedelsupptäckt. Han har länge varit intresserad av kaotiska processers kemi, vilket lockade honom till utmaningen att tämja MYC.
"MYC representerar kaos, i grunden, eftersom det saknar struktur. Det och dess direkta inverkan på så många typer av cancer gör det till en av de heliga gralerna för utveckling av cancerläkemedel," sa Xue. "Vi är väldigt glada över att det nu är inom vårt räckhåll."
Mer information: Zhonghan Li et al, MYC-Targeting Inhibitors Generated from a Stereodiversified Bicyclic Peptide Library, Journal of the American Chemical Society (2024). DOI:10.1021/jacs.3c09615
Journalinformation: Tidskrift för American Chemical Society
Tillhandahålls av University of California - Riverside