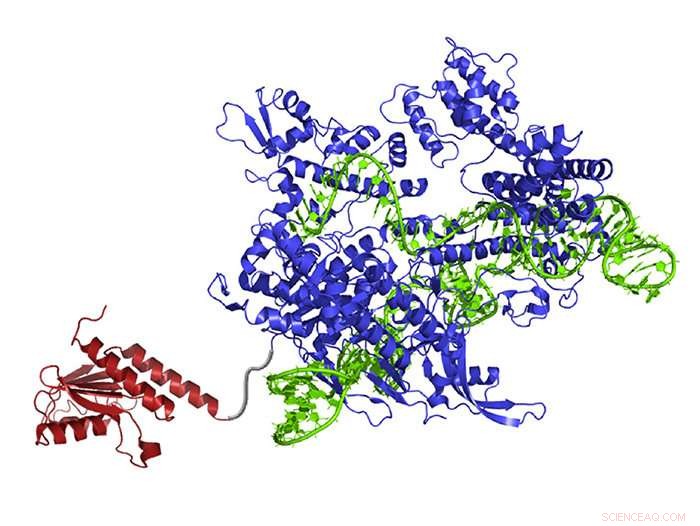
En nyskapad DNA-basredigerare innehåller ett atomomarrangerande enzym (rött) som kan ändra adenin till inosin (läs och kopieras som guanin), guide RNA (grönt) som leder molekylen till rätt plats, och Cas9 nickase (blått), som klipper av den motsatta DNA-strängen och lurar cellen att byta ut den komplementära basen. Kredit:Gaudelli et al./ Natur 2017
Forskare vid Harvard University och Broad Institute of MIT och Harvard har utvecklat en ny klass av genomredigeringsverktyg. Denna nya "basredigerare" kan direkt reparera den typ av enbokstavsförändringar i det mänskliga genomet som står för ungefär hälften av mänskliga sjukdomsassocierade punktmutationer. Dessa mutationer är förknippade med sjukdomar som sträcker sig från genetisk blindhet till sicklecellanemi till metabola störningar till cystisk fibros.
Forskargruppen, ledd av David Liu, professor i kemi och kemisk biologi vid Harvard University, kärninstitutsmedlem vid Broad Institute, och en utredare från Howard Hughes Medical Institute (HHMI), utvecklat en molekylär maskin som kan omvandla DNA-basparet A* T till G* C, utan att skära den dubbla helixen, med hög effektivitet och praktiskt taget inga oönskade produkter. Utvecklingen är ett viktigt tillägg till den växande uppsättningen av genomredigeringsverktyg.
Det nya systemet beskrivs i en tidning som publicerades idag i Natur . Förutom Liu, studien leddes av Nicole Gaudelli, en postdoktor i Lius labb; Alexis Komor, en före detta postdoktor i Lius labb som nu är biträdande professor vid UCSD; doktorand Holly Rees; tidigare doktorander Michael Packer och Ahmed Badran, och tidigare postdoktor David Bryson.
Det nya systemet, dubbad Adenine Base Editor, eller ABE, kan programmeras för att rikta in sig på ett specifikt baspar i ett genom med hjälp av ett guide-RNA och en modifierad form av CRISPR-Cas9. Det fungerar genom att omordna atomerna i ett måladenin (A) - en av de fyra baserna som utgör DNA - för att istället likna guanin (G), och sedan lura celler att fixera den andra DNA-strängen för att slutföra basparomvandlingen, göra förändringen permanent. Som ett resultat, det som tidigare var ett A* T-baspar blir ett G* C-baspar.
Inte bara är systemet mycket effektivt jämfört med andra genomredigeringstekniker för att korrigera punktmutationer, men det finns praktiskt taget inga detekterbara biprodukter som slumpmässiga insättningar, raderingar, translokationer, eller andra bas-till-bas-omvandlingar.
Att göra denna specifika förändring är viktigt eftersom ungefär hälften av de 32, 000 sjukdomsassocierade punktmutationer som redan identifierats av forskare är en förändring från G* C till A* T.
"Vi utvecklade en ny basredigerare - en molekylär maskin - som i en programmerbar, irreversibel, effektiv, och rent sätt kan korrigera dessa mutationer i genomet av levande celler, sa Liu, som också är Richard Merkin-professor och direktör för Merkin Institute of Transformative Technologies in Healthcare at the Broad. "När de riktas mot vissa platser i mänskligt genomiskt DNA, denna omvandling vänder den mutation som är associerad med en viss sjukdom."
ABE går med i andra basredigeringssystem som banat väg i Lius labb, såsom BE3 och dess förbättrade variant, BE4. Genom att använda dessa basredigerare, forskare kan nu korrigera alla så kallade "övergångs"-mutationer - C till T, T till C, A till G, eller G till A – som tillsammans står för nästan två tredjedelar av alla sjukdomsorsakande punktmutationer, inklusive många som orsakar allvarliga sjukdomar för vilka det inte finns någon aktuell behandling. Ytterligare forskning behövs, Liu noterar, för att göra det möjligt för ABE att rikta in så mycket av genomet som möjligt, som Liu och hans elever tidigare uppnått genom ingenjörsvarianter av BE3.
Utvecklingen av den nya basredigeraren började när teamet påbörjade en årslång ansträngning för att utveckla ett nytt enzym som kunde omvandla adenin till inosin (I), en nukleotid som beter sig på samma sätt som G under DNA- eller RNA-syntes. Projektet, ledd av Gaudelli, resulterade i slutändan i högpresterande, sjunde generationens ABE.
"Den största utmaningen för mig när jag utvecklade ABE var att övervinna det psykologiska hindret om ABE kunde gå från idé till verklighet eller inte, eftersom nyckelkomponenten i redaktören inte existerade naturligt och måste utvecklas i vårt labb, " sa Gaudelli. "Det var viktigt att behålla tron att vi inte bara kunde drömma om en sådan molekylär maskin, men också bygga den."
För att visa ABE:s potential, Liu och kollegor använde först ABE för att direkt korrigera en mutation som orsakar ärftlig hemokromatos (HHC) i mänskliga celler.
De använde också ABE för att installera en mutation i mänskliga celler som undertrycker en sjukdom, återskapa den så kallade "brittiska mutationen" som finns hos friska individer som normalt skulle utveckla blodsjukdomar som sicklecellanemi men istället ha en mutation som gör att fostrets hemoglobingener förblir aktiva efter födseln, skydda dem från blodsjukdomar.
Även om utvecklingen av ABE är ett spännande steg framåt inom basredigering, mer arbete återstår innan grundredigering kan användas för att behandla patienter med genetiska sjukdomar, inklusive säkerhetstester, effektivitet, och biverkningar.
"Att skapa en maskin som gör den genetiska förändringen du behöver för att behandla en sjukdom är ett viktigt steg framåt, men det är bara en del av vad som behövs för att behandla en patient, " sa Liu. "Vi måste fortfarande leverera den maskinen, vi måste testa dess säkerhet, vi måste bedöma dess fördelaktiga effekter på djur och patienter och väga dem mot eventuella biverkningar – vi måste göra många fler saker."
"Men att ha maskinen är en bra början."