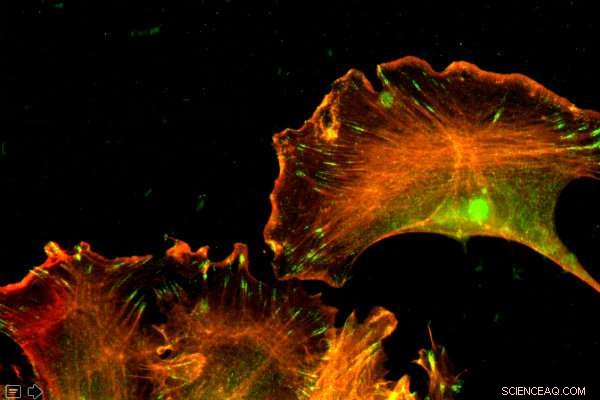
Aktin är ett rikligt protein, finns i varje cell. Penn Vet-forskare visade att skillnader i nukleotidernas ordning - inte aminosyrorna - styrde de distinkta funktionerna hos två former av aktin. Kredit:University of Pennsylvania
Människor har sex former av proteinet aktin, som utför viktiga funktioner i kroppen. Två i synnerhet, β-aktin och γ-aktin, är nästan identiska, skiljer endast med fyra aminosyror. Ändå har dessa nära-tvillingproteiner distinkta roller. En långvarig fråga för biologer har varit, hur är detta möjligt?
"Det är ett mysterium som har diskuterats inom området under de senaste 40 åren, "sa Anna Kashina, professor i biokemi vid University of Pennsylvania School of Veterinary Medicine.
Nya rön av Kashina och kollegor har pekat på ett överraskande svar. De olika funktionerna hos dessa proteiner bestäms inte av deras aminosyrasekvenser utan av deras genetiska kod.
"Vi gillar att kalla det "tysta koden, "" sa Kashina. "Våra fynd visar att de delar av gener som vi tänker på som tysta faktiskt kodar för mycket viktig funktionell information."
Forskarna fann att dessa "tysta" skillnader i nukleotidsekvensen verkar påverka tätheten av ribosomer, de molekylära maskiner som översätter RNA till proteiner. Sådana skillnader kan göra det möjligt för varje enskild aktinform att ta en annan roll i cellen.
Kashina var medförfattare till arbetet, publiceras i tidskriften eLife , med Penn Vet's Pavan Vedula, Satoshi Kurosaka, Nicolae Adrian Leu, Junling Wang, Stephanie Sterling och Dawei Dong och National Institutes of Health's Yuri I. Wolf och Svetlana A. Shabalina.
Aktin är så allmänt förekommande och viktigt att det är känt som ett "hushållsprotein". Det är det mest förekommande proteinet i de flesta celler, och dess olika former spelar roller under cellmigrering, muskelkontraktion och utveckling. Under en tid, forskare trodde att de olika formerna var funktionellt överflödiga, existerar endast för att fungera som backup om en form hade ett fel.
På senare tid, forskare har förstått att formerna inte är överflödiga; vissa lokaliseras till olika delar av cellerna, vissa är inkorporerade i olika delar av cytoskelettet. Och när dessa proteiner manipuleras, resultaten är också olika.
När β-aktin saknas, till exempel, möss dör i ett tidigt skede av embryonal utveckling. Men möss som saknar γ-aktin, men vanligtvis mindre än normalt och döva, kan överleva till vuxen ålder.
I en rapport från 2010 i Science, Kashinas grupp tog ett steg mot att få en förståelse för vad som avgör dessa skillnader. Om man tittar på en proteinmodifiering som normalt bara finns i β-aktin, de fann att anledningen till att det inte också fanns på y-aktin berodde på variationer i den kodande sekvensen mellan de två aktingenerna.
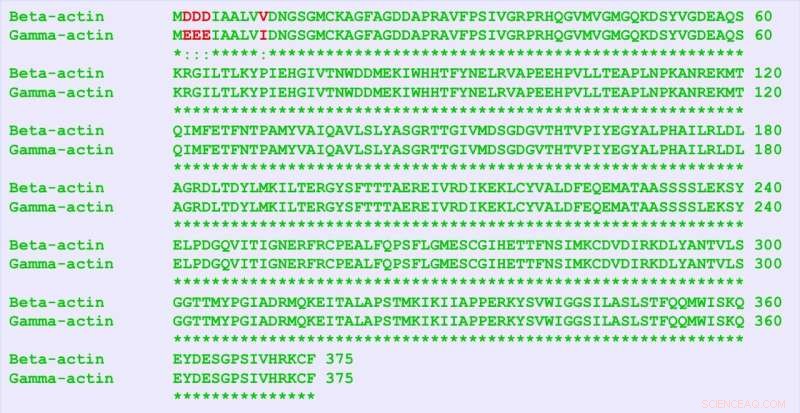
β-aktin och γ-aktin är nästan identiska proteiner, skiljer sig endast med fyra aminosyror (i rött). Men de innehåller många fler skillnader i deras nukleotidsekvens, och denna "tysta kod" är ansvariga distinkta funktioner för de två proteinerna, fann forskarna. Upphovsman:University of Pennsylvania
"Vi ville bygga vidare på det här, " sa Kashina, "och bestämde sig för att testa hypotesen, 'Tänk om deras funktionella skillnader inte hade något att göra med deras aminosyrasekvens; tänk om allt finns i generna?'"
Forskarna utnyttjade den precisionsgenredigering som möjliggjorts av CRISPR/Cas-9-systemet. Medan de två aktinisoformerna endast skiljer sig åt med fyra aminosyror, deras mRNA -kodande sekvenser skiljer sig med nästan 13 procent på grund av "tysta" nukleotidskillnader som ändå kodar för samma aminosyror. Göra ändringar av endast fem nukleotider i β-aktingenen, de kunde transformera det så att dess aminosyraproduktion skulle vara exakt samma som y-aktinproteinet. Allt som skulle särskilja det skulle vara de tysta nukleotidsubstitutionerna.
Genredigeringen fungerade. Möss med dessa redigeringar hade inget β-aktinprotein. Men till skillnad från äkta β-aktin knockouts var de helt friska och livskraftiga, precis som om de hade de rätta proportionerna av β-aktin och γ-aktinproteiner. De överlevde för att fortplanta sig och hade i genomsnitt samma kullstorlekar som normala djur.
Forskarna utförde samma experiment, redigering av y-aktingenen för att koda för p-aktinproteinet men kunde bara ändra den kodande sekvensen för tre av de fyra aminosyrorna. Fortfarande, möss som utsatts för denna partiella ersättning verkade också normala och friska, trots att den saknar y-aktinprotein.
I uppföljande experiment, Kashinas team fann att y-aktinproteinerna från den redigerade β-aktingenen bildade ett normalt cytoskelet och gjorde det möjligt för cellen att migrera på ett normalt sätt.
"Om bara nukleotidsekvensen är viktig för proteinfunktionen, då borde mössen inte bry sig om vilket protein de har, sa Kashina. "Och mössen brydde sig inte."
Att komma fram till en mekanism för hur DNA-sekvens kan påverka proteinfunktionen, forskarna fann att ribosomdensiteten på β-aktin-RNA är mer än tusen gånger högre än på γ-aktin-RNA, och faktiskt alla sex aktingenerna hade skillnader i ribosomdensitet.
"Detta tyder på att β-aktin kan översättas till protein kanske tusen gånger snabbare än γ-aktin, sa Kashina.
Och nyfiken på hur utbrett detta fenomen kan vara, forskarna letade efter proteinfamiljer med nästan identiska medlemmar som kodas av olika gener och hade betydande variationer i ribosomtäthet i hela familjen. De hittade många grupper som delades mellan möss, zebrafisk och mänskliga genom.
"Vi tror att denna form av funktionell reglering är ett globalt fenomen, "Kashina sa, och det är något som hennes labb kommer att fortsätta att undersöka.