Grafiskt abstrakt. Kredit:Molecular Cell (2022). DOI:10.1016/j.molcel.2022.06.031
Under fyra decennier har Specificity Protein 1 (Sp1) enbart gjutits som en transkriptionsfaktor, en typ av protein som binder DNA och sätter på gener. Men en Donnelly Center-studie har nu avslöjat att Sp1 spelar en annan oväntad roll i genreglering genom att påverka stabiliteten hos geners RNA-meddelanden.
Fyndet är särskilt viktigt för cancerforskningen, eftersom det höjer det etablerade tänkandet om hur Sp1 bidrar till sjukdomen och öppnar nya vägar för behandlingsutveckling.
"Sp1 har varit känt för att vara involverat i cancer under lång tid, men det ansågs bero på dess förmåga att binda DNA och fungera som en transkriptionsfaktor, eftersom alla visste om det", säger Jack Greenblatt, senior författare på paper och professor i molekylär genetik vid Donnelly Center for Cellular and Biomolecular Research, vid U of T:s Temerty Faculty of Medicine.
"Vi tror att det inte är svaret. Vi tror att det påverkar cancer genom dess förmåga att binda RNA och reglera transkriptstabilitet", säger Greenblatt, som också är universitetsprofessor.
Tidskriften Molecular Cell publicerade resultaten.
Forskningen kastar oväntat nytt ljus över ett av de mest studerade mänskliga proteinerna. Sp1 identifierades först som en DNA-bindande transkriptionsaktivator för nästan 40 år sedan och var den första mänskliga transkriptionsregulatorn som renades, säger Greenblatt. "Det är ett standardämne i läroböcker för grundutbildning", tillade han.
Sp1 kontrollerar aktiveringen av cirka 6 000 gener – ungefär en tredjedel av det mänskliga genomet – som mestadels krävs för cellulär näring.
Och nu finns det också den RNA-bindande Sp1, som har makt över en annan och mestadels icke-överlappande grupp av 2 000 gener genom att påverka mängden av deras mRNA-kopior, enligt studien.
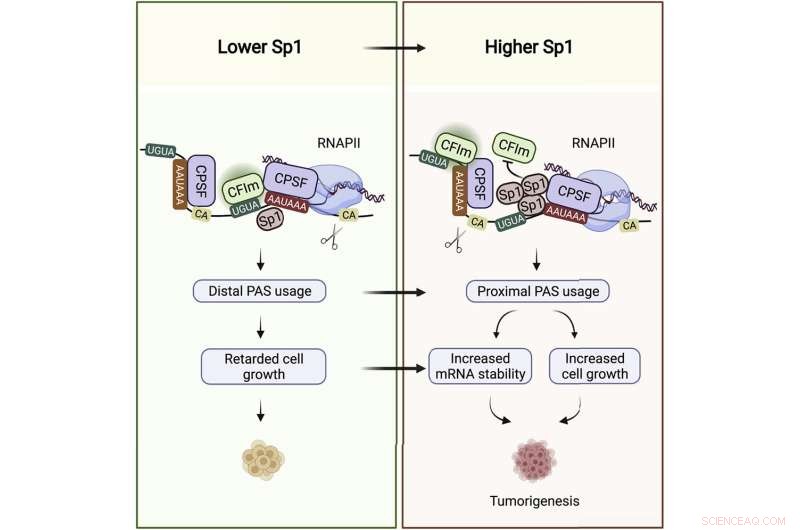
När en gen slås på, kopieras dess kod till ett budbärar-RNA, eller ett transkript, som fungerar som en mall för att bygga den kodade proteinmolekylen. Vid sin svansände hyser mRNA den otranslaterade regionen, eller UTR, som inte översätts till protein, men som har en reglerande roll och är viktig för transkriptstabilitet. Forskning har visat att transkript med långa UTR-svansar ofta är mindre stabila och bryts ned snabbare av cellulära enzymer, medan kortsvansade UTR:er är mer skyddade från nedbrytning.
"Det är här, i UTR, som Sp1 binder sina mål-mRNA", säger Syed Nabeel-Shah, en Ph.D. kandidat i labbet och forskningens första författare, tillsammans med tidigare Greenblatt-laboratoriets postdoktor, Jingwen Song. När Nabeel-Shah och Song utarmade Sp1 från celler, fann de att detta ledde till en ökning av vissa transkripts UTR-längd, vilket indikerar att Sp1 verkar för att ge kortare UTR-svansar. De visade vidare att UTR-trimning åstadkoms av RNA-klyvningsmaskineriet, som klipper av RNA nära där Sp1 är bundet.
Kontroll av UTR-längd har dykt upp som ett viktigt lager av genreglering. Detta gäller särskilt cancerceller, som finns i överflöd av kortsvansade transkript. Ju kortare UTR-svans är, desto stabilare är mRNA för många transkript, vilket innebär fler proteinmallar – och i slutändan fler proteinmolekyler som kan produceras.
"Snabbväxande celler behöver vissa gener uttryckta på högre nivåer", säger Greenblatt. "Effekten av att ha kortare UTR är ofta en högre koncentration av mRNA, och följaktligen högre proteinkoncentration."
Det förblev dock oklart hur balansen är snedställd mot kortare UTR i cancerceller. Men Greenblatt och Nabeel-Shah tror att Sp1 har en del av nyckeln.
Det har länge varit känt att Sp1-nivåer är förhöjda över många typer av cancer, inklusive bröstcancer, som Nabeel-Shah och Song fokuserade sin analys på. De fick RNA-sekvenseringsdata från Cancer Genome Atlas på tusen bröstcancerpatienter. De fann att Sp1-nivåer korrelerar med dess måltranskriptionslängd och överflöd. Ju mer Sp1 i ett patientprov, desto kortare är UTR i samma prov och desto högre mRNA-nivåer när dessa UTR är bundna av Sp1. "Allt detta tyder på att Sp1 främjar cancer genom sin RNA-bindande roll", säger Nabeel-Shah.
Fyndet står i kontrast till den etablerade uppfattningen där Sp1 bidrar till cancer genom att turboladda uttrycket av dess målgener som ett DNA-bindande protein. Nabeel-Shah och Song hittade inget stöd i data för detta koncept. Det fanns ingen signifikant korrelation mellan Sp1-nivåer i bröstcancerceller och mängden mRNA som transkriberats från generna som den riktar in sig på på DNA.
Även om de bara tittade på bröstcancer tror forskarna att Sp1 spelar en liknande roll i andra typer av cancer, med tanke på det stora antalet mRNA som den reglerar.
Studien öppnar för ett nytt sätt att tänka inte bara om Sp1 och dess roll i cancer, utan också om andra liknande proteiner. Sp1 tillhör en familj av C2H2 zinkfingertranskriptionsfaktorer, som utgör den största gruppen av transkriptionsfaktorer hos människor. Majoriteten av dess över 700 medlemmar är dock fortfarande dåligt utforskade.
Målet med Nabeel-Shahs avhandling är att avgöra om många andra C2H2-proteiner också binder RNA. Hittills har han testat 150 av dessa proteiner och funnit att 145 binder både DNA och RNA, vilket tyder på att många andra medlemmar också kan ha dubbla roller i genreglering.
Sp1 var bara den första som upptäcktes, precis som för fyra decennier sedan. + Utforska vidare