Grafiskt abstrakt. Kredit:Current Biology (2022). DOI:10.1016/j.cub.2022.05.021
Under de senaste åren har CRISPR gripit rubriker för att hjälpa patienter med så olika tillstånd som blindhet och sicklecellssjukdom. Men långt innan människor antog CRISPR för att bekämpa genetiska sjukdomar, använde bakterier CRISPR som ett immunsystem för att bekämpa virus.
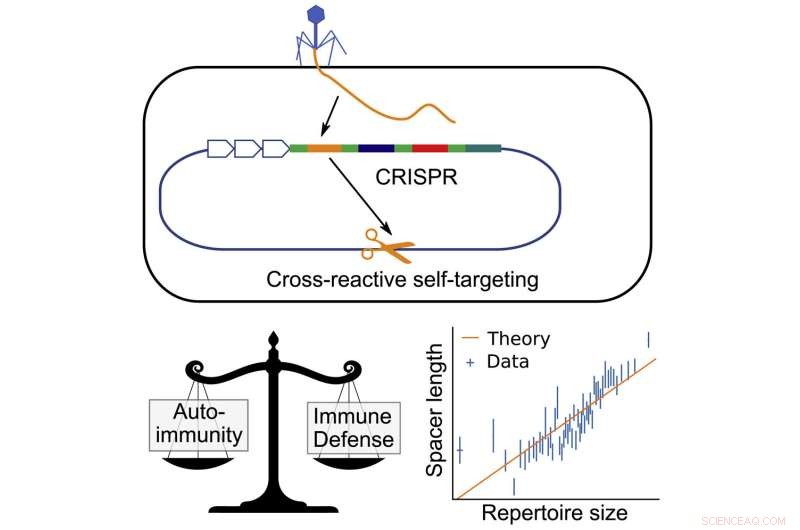
I bakterier fungerar CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) genom att stjäla små bitar av DNA från infekterande virus och lagra dessa bitar i bakteriernas gener. Dessa bitar av DNA, som kallas spacers, kopieras sedan för att bilda små taggar, som fäster på proteiner som flyter runt tills de hittar en matchande bit av DNA. När de hittar en match känner de igen det som ett virus och skär upp det.
Nu, en artikel publicerad i Current Biology av forskare från University of Pennsylvania Department of Physics and Astronomy visar att risken för autoimmunitet spelar en nyckelroll i att forma hur CRISPR lagrar viral information, vägleder hur många spacers bakterier håller i sina gener och hur långa dessa spacers är.
Helst ska spacers bara matcha DNA som tillhör viruset, men det finns en liten statistisk chans att spacern matchar en annan bit av DNA i själva bakterien. Det kan innebära döden från en autoimmun reaktion.
"Det adaptiva immunsystemet hos ryggradsdjur kan producera autoimmuna sjukdomar. De är mycket allvarliga och farliga, men folk hade inte riktigt övervägt så noggrant för bakterier", säger Vijay Balasubramanian, chefsutredare för tidningen och professorn i Cathy och Marc Lasry. Fysik i högskolan för konst och vetenskap.
Att balansera denna risk kan sätta bakterierna i något av en evolutionär bindning. Att ha fler spacers innebär att de kan lagra mer information och avvärja fler typer av virus, men det ökar också sannolikheten för att en av spacers kan matcha DNA:t i bakterierna och utlösa ett autoimmunt svar.
Balasubramanian, tillsammans med medförfattarna Hanrong Chen från Genome Institute of Singapore och Andreas Mayer från University College London, insåg att bakterierna kunde komma runt detta genom att ha längre spacers. I likhet med hur ett längre lösenord kan vara svårare att knäcka, skulle en längre spacer vara mindre sannolikt att matcha med själva bakteriens DNA. Detta innebär att bakterier med längre spacers totalt sett skulle kunna ha fler spacers utan risk för att utlösa ett autoimmunt svar.
Med denna idé i hand byggde forskarna en matematisk modell för att beräkna förhållandet mellan spacers längd och det totala antalet spacers som bakterierna ska kunna lagra utan att riskera en autoimmun respons.
När de väl utarbetat den matematiska modellen, kontrollerade de om deras förutsägelse stämde i faktiska bakterier genom att titta på CRISPR-DNA från tusentals arter och jämföra spacers längd med antalet lagrade spacers.
Forskarna fann ett konsekvent, snävt samband mellan distansens längd och antalet distansbrickor.
"Förvåningen för mig är att den matchade så jäkla bra när den kom ut ur lådan", säger Balasubramanian. "Det här är ett väldigt enkelt teoretiskt ramverk. Det finns en risk för autoimmunitet, men det är trevligt att ha mer immunminne, och du måste balansera dessa två överväganden. Det är bara väldigt, väldigt sällsynt att något så enkelt matchar data."
Balasubramanian säger att framgången med modellen visar att detta ramverk av enkla, matematiska avvägningar kan gälla mer komplexa system, såsom immunsystemet hos ryggradsdjur, inklusive människor.
"Bara genom att göra den där statistiska typen av resonemang kan du göra stora framsteg", säger han. "Så vi kanske kan gå tillbaka till immunitet hos ryggradsdjur och använda samma teknik."
Denna studie är också bland de första som beskriver vikten av det autoimmuna svaret hos bakterier. Balasubramanian och hans medarbetare hoppas att framtida studier av CRISPR kommer att överväga risken för autoimmunitet.
När det gäller framtida arbete i sin grupp, siktar han på att utforska hur CRISPR lagrar information som svar på utvecklande virus. Och även om en statistisk modell av utvecklande bakteriegener kan tyckas långt borta från det dagliga livet, säger Balasubramanian att detta arbete lägger en grund för en bredare förståelse av immunitet, på sätt som kan möjliggöra djupare insikt om virus som säsongsinfluensa eller nya SARS-CoV -2 varianter.
Säger Balasubramanian, "Dessa är alla bitar i ett större pussel."