Grafiskt abstrakt. Kredit:Cell Host &Microbe (2022). DOI:10.1016/j.chom.2022.03.014
Fagterapi, som använder virus som kallas bakteriofager för att behandla bakterieinfektioner, är en långvarig medicinsk procedur vars verkningsmekanismer fortfarande är dåligt förstådda. Forskare från Institut Pasteur och CNRS har visat in vivo i en murin modell att bakterier är kapabla att reglera sitt genuttryck för att undvika de många bakteriofager som finns i tarmmiljön. Denna forskning förklarar skillnaden i bakteriofags effektivitet mellan in vitro och in vivo tillstånd. Resultaten publicerades i tidskriften Cell Host &Microbe den 13 april 2022.
Fagterapi är ett medicinskt tillvägagångssätt som involverar behandling av bakteriella infektionssjukdomar med hjälp av den naturliga förmågan hos vissa virus, kända som bakteriofager, att döda bakterier som de specifikt känner igen. En betydande minskning av användningen av denna terapeutiska strategi som upptäcktes för över 100 år sedan sågs i väst efter utvecklingen av antibiotika. Men inför en alarmerande ökning av antalet infektioner orsakade av antibiotikaresistenta bakterier och den oroande utsikten att lämnas utan behandlingsalternativ, försöker forskare belysa bakteriofagers verkningsmekanism.
Bakterier och bakteriofager är de vanligaste enheterna i människans tarmmikrobiota. Även om bakteriofager dödar bakterier, samexisterar de två antagonistpopulationerna i en balans i tarmen.
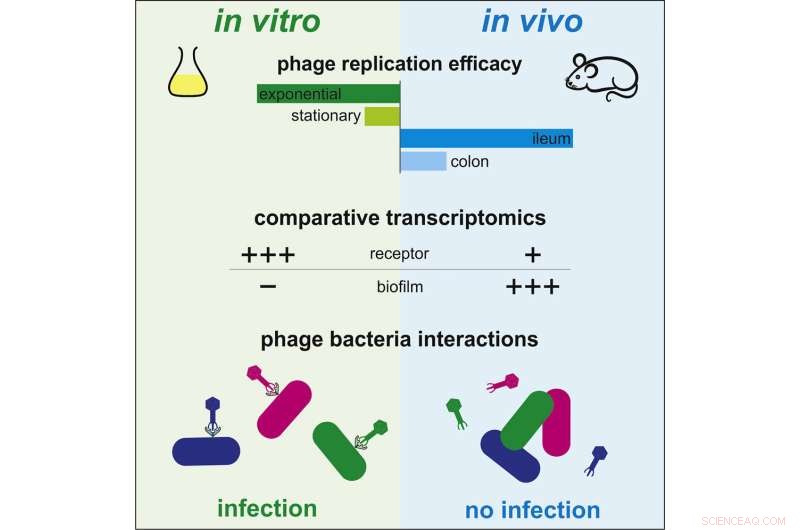
Fram till nu har otillräckliga vetenskapliga data funnits tillgängliga för att förstå hur fagterapi fungerar in vivo. Interaktioner mellan bakterier och bakteriofager har däremot studerats omfattande in vitro. Under dessa förhållanden infekterar bakteriofager snabbt bakterier, replikerar och förstör bakterier, samtidigt som de frigör nya virus som kan infektera andra bakterier. Emellertid är dynamiken som observeras mellan dessa två mikroorganismer mycket olika i tarmen hos däggdjur. Vissa bakteriofager som är effektiva i odlingsmedium är totalt ineffektiva i tarmmiljön.
För att förstå denna skillnad beslutade forskare vid Institut Pasteur och CNRS att jämföra genuttrycksprofilen, eller transkriptomet, för bakterien Escherichia coli i båda sammanhangen:odlingsmedia och tarmen. Med denna metod avslöjade de genetiska regleringar som kännetecknar bakteriens anpassning till tarmmiljön.
Genom att noggrant undersöka generna som är involverade i denna anpassning avslöjade de fyra gener som modulerar bakteriens mottaglighet för bakteriofager. "Vi observerade att vissa gener som krävs för infektion av bakteriofager uttrycks mindre i tarmen än in vitro, vilket skyddar bakterier från bakteriofager", kommenterade Laurent Debarbieux, chef för Bacteriophage, Bacterium, Host Unit vid Institut Pasteur (CNRS gemensamma enhet) och sista författare till studien. Forskarna kunde verifiera sin teori genom att eliminera uttrycket av en viss gen. De observerade att bakteriell mottaglighet för en bakteriofag minskade avsevärt. Följaktligen kan bakterier i tarmen motstå predation av bakteriofager genom att modulera uttrycket av vissa gener snarare än att mutera deras genom.
Denna studie visar därför att miljön spelar en dominerande roll i interaktioner mellan bakterier och bakteriofager. Dessa fynd banar väg för förbättrad användning av bakteriofager för terapeutiska ändamål.