
Kredit:Wikipedia commons
En av de största utmaningarna inom biologin idag är att förklara strukturen hos cristae, mitokondriernas inre membran. En förklaring i detta fall är en uppsättning principer för att förutsäga vilken form cristae kommer att ta efter grundläggande metaboliska manipulationer av miljön mitokondrierna befinner sig i. Dessa principer kommer därför att vara en beskrivning av mitokondriernas verkliga funktion, något som hittills bara har knappt föreställts.
De senaste framstegen inom tekniker som levande cells superupplösningsljusmikroskopi och elektrontomografi har gett ny insikt om cristaes dynamiska beteende. En detaljerad arkitektur av hela mitokondriella volymen kan nu konstrueras från en serie lutningsbilder som projiceras bakåt för att skapa 3D-tomogram. På måndagen diskuterade vi hur cristae förvandlas och omkonfigureras enligt mängden och hälsan hos flera inre membran- och matrisproteiner. Förevändningen för den analysen var de strukturella och biokemiska likheterna mellan membran i mitokondrier, tylakoider och myelin som förmodligen hjälper till att kanalisera metaboliter i produktionen av energi.
I en ny artikel från The Royal Society's Open Biology , förklarar forskare cristaes biogenes genom de koordinerade aktiviteterna av fyra stora vägar som är evolutionärt bevarade från protister och jästsvampar upp till högre eukaryoter som vi själva:dimerbildning och oligomerisering av ATP-syntaset vid cristae-kanterna, sammansättning av den "mitokondriella kontaktplatsen" and cristae organizing system' (MICOS) vid crista junctions, membranombyggnad av ett inre membran-associerat, dynaminrelaterat GTPas (Mgm1 i jäst och OPA1 i däggdjur) och korrekt justering av membranets lipidsammansättning.
För den första vägen som involverar ATP-syntaset är flera saker uppenbara. Som vi rapporterade tidigare, dikterar den spontana dimeriseringen av ATP-syntas vid exakt definierade och artberoende vinklar i ordnade rader bottenvåningens geometri. I motsats till andningskomplex I-IV, som är sammansatta på det platta inre gränsmembranet, är ATP-syntas (komplex V) helt sammansatt djupt i cristae-membranen. Medan flera ATP-syntas-subenhetsproteiner är nödvändiga för korrekt cristae-bildning, är Atp20- och Atp21-subenheterna absolut nödvändiga.
Ett överskott av ADP inducerar en kondenserad konformation med stora, svullna intra-kristala utrymmen. Däremot, under ADP-begränsande förhållanden, antar mitokondrier den ortodoxa konformationen med sammandraget intrakristalt utrymme. Hos jätteamöban Chaos carolinensis innehåller mitokondrier normalt slumpmässigt orienterade rörformiga cristae. Med svält antar förstorade cristae en kubisk morfologi med ett sicksackliknande mönster. Hos möss orsakar apoptotiska medel sammansmältning av individuella cristae med efterföljande frisättning av cytokrom c från det intrakristala utrymmet in i gränsregionen.
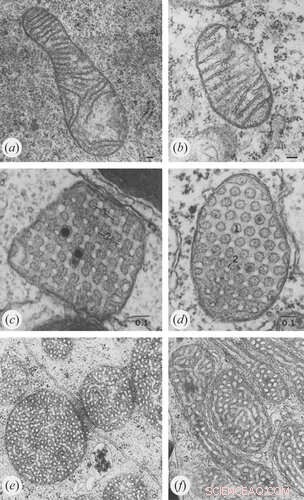
Kredit:Klecker och Westermann, Open Biology (2021). DOI:10.1098/rsob.210238
För den andra vägen, sammansättningen av MICOS-kontaktställen, har forskning fastställt att kritiska proteiner som de från den MIC60-relaterade genfamiljen finns så långt tillbaka som mitokondriernas endosymbiotiska förfäder - α-proteobakterierna. Många av dessa tidigare mitokondriella bärare visar redan differentierade intracytoplasmatiska membranstrukturer. Arter som har förenklat sina mitokondrier till den grad att cristae är frånvarande saknar alltid de MICOS-relaterade generna. Återuttryck av MIC60-homologer till Δmic60-jästmutanter räddar de ultrastrukturella mitokondriella defekterna.
Den tredje vägen inkluderar de dynaminrelaterade GTPaserna, som koordinerar fusion och fission av både inre och yttre membran. Vid fission polymeiseras dessa proteiner till kontraktila ringar som applicerar sammandragande krafter för att klämma ihop mitokondrier. Resultatet förstås nu vara beroende av interaktioner mellan dessa proteiner, både med MICOS-komplexet och cristae junctions, och även de inre och yttre membrantransportsystemen som samlas där. Dessa inkluderar TIM- och TOM-membrantranslokatorkomplexen.
Den fjärde vägen omfattar själva mitokondriella membranfosfolipiderna. Mitokondrier hyser kardiolipinbiosyntesvägen och är också involverade i syntesen av fosfatidyletanolamin. Tillsammans med fosfatidylkolin är dessa tre huvudsakliga fosfolipider som mitokondrierna arbetar med. De flesta av byggstenarna för mitokondriella lipider syntetiseras i ER och måste därför importeras in genom mekanismer som involverar nära apposition till ER. Väl inne i det yttre membranet medieras fördelningen av lipider av intermembran-rymden-lokaliserade transportproteiner från Ups/PRELI-familjen,
Mitokondrier skapar inte geometri från grunden, utan utnyttjar och bygger på de naturliga fysiska former som uppstår spontant i lipider. Överlåtna till sina egna enheter bildar lipider koncentriska lamellära strukturer som sedan kan expanderas och förstärkas med specifika proteiner. Finskaliga mätningar har nu visat att enskilda kristaller är funktionellt oberoende och kan ha signifikant olika membranpotentialer.
Cristae-bildningen innebär ett tätt sammankopplat samspel av de fyra ovanstående formningsinfluenserna. For example, the activities of the MICOS complex and ATP synthase dimerization are both cooperative and antagonistic. MICOS induces negative membrane curvature while the ATP synthase induces positive curvature at cristae tips and rims. New computational models, as currently under development in labs throughout the world, where ratios of these different components can be finely tweaked and adjusted, will greatly aid in defining what controls the form of mitochondria.