Ett team som leds av forskare vid Weill Cornell Medicine och New York Genome Center har utvecklat en avancerad metod för att avslöja hur genmutationer stör den normala packningen av DNA. Dessa strukturella förändringar, som förändrar mönster av genaktivitet i en cell, är kända som epigenetiska förändringar och kan leda till malignitet.
Den nya metoden, beskriven i en artikel publicerad i Nature , erbjuder biologer ett kraftfullt verktyg som kan tillämpas inom många undersökningsområden, från grundläggande cellbiologi till studiet av hur cancer uppstår. Forskarna demonstrerade den nya metoden genom att använda den för att belysa hur en vanlig genmutation utövar sina effekter på två sällsynta blodcancerformer.
"Denna nya teknik bör möjliggöra breda framtida utforskningar av sambanden mellan mutationer och epigenetiska förändringar i samband med cancer och relaterade tillstånd", säger seniorförfattaren Dr Dan Landau, professor i medicin vid avdelningen för hematologi och medicinsk onkologi vid Weill. Cornell Medicine och en kärnfakultetsmedlem vid New York Genome Center.
Studien leddes tillsammans av Dr. Franco Izzo, en postdoktor vid Landau Lab under studien, nu biträdande professor vid Icahn School of Medicine vid Mount Sinai.
Den nya bedriften är den senaste i raden av encellsprofileringsinnovationer från Landaus forskargrupp. Sådana metoder, även kallade "single-cell multi-omics"-metoder, gör det möjligt för forskare att karakterisera DNA-mutationer, genaktivitetsmönster, cellytproteiner och andra lager av information – allt i en enskild cell, med hjälp av automatisering för att bearbeta många tusen celler åt gången.
Däremot används äldre metoder på bulkprover, som vanligtvis innehåller blandningar av olika celltyper såväl som både muterade och icke-muterade celler – vilket i hög grad begränsar all analys.
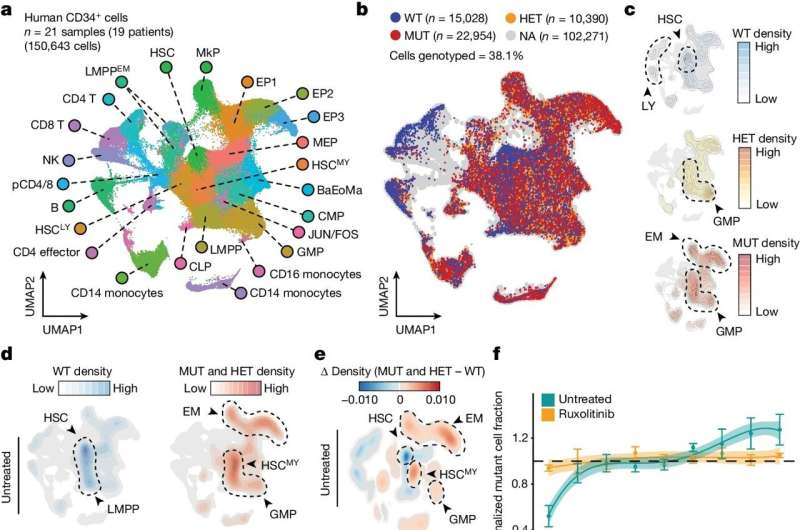
I det här fallet utvecklade teamet en mer känslig och exakt encellsmetod för att upptäcka DNA-mutationer av intresse. De kombinerade sedan detta med en ny teknik för att kartlägga en cells "kromatintillgänglighet" – i huvudsak de platser där DNA är relativt öppet och tillgängligt för gentranskription – som en bred bild av cellens epigenetiska tillstånd.
Forskarna kallade dessa parade tekniker "Genotyping av riktade loci med enkelcellskromatintillgänglighet" eller "GoT-ChA" och visade att de kunde integrera GoT-ChA med encellsmetoder för att profilera andra informationsskikt som RNA och cell- ytproteiner.
Forskarna visade kraften i deras nya verktygslåda genom att använda den för att studera blodkroppar från patienter med två sällsynta blodcancerformer, polycytemia vera och myelofibros. Dessa cancerformer drivs vanligtvis av en specifik mutation i en gen som kallas JAK2 – en mutation som har varit inblandad i andra tillstånd och som också finns hos många till synes friska människor.
Båda cancerformerna har också störningar i den normala blodcellsmognadsprocessen, vilket innebär att JAK2-mutationen inducerar betydande epigenetiska förändringar - men begränsningarna hos äldre metoder innebar att dessa epigenetiska förändringar och andra nedströmseffekter av mutationen inte var väl förstått. Med GoT-ChA kunde forskarna katalogisera dessa effekter i detalj.
"Man trodde att vid myelofibros, till exempel, drivs benmärgsinflammation av märgmikromiljön, men vi upptäckte att inflammatoriska förändringar i blodstamceller är ett direkt resultat av JAK2-mutationen och också beror på celltypen", säger Landau, som är också medlem av Sandra och Edward Meyer Cancer Center och Englander Institute of Precision Medicine vid Weill Cornell Medicine.
Resultaten tyder på att potenta nya JAK2-hämmare, som för närvarande är under utveckling, kan vara till hjälp vid behandling av myelofibrospatienter, sa han.
Landau noterade att GoT-ChA generellt sett borde vara användbar för att studera tillstånd där DNA-mutationer – som kan uppstå under hela livet av olika anledningar – finns i endast en minoritet av celler i ett organ och därför är svåra eller omöjliga att studera med traditionella , för-encellstekniker.
Studiens första författare, förutom Izzo, var M.D.-Ph.D. student Robert Myers, postdoktor Saravanan Ganesan och doktorand Levan Mekerishvili, alla från Landau Laboratory.
Mer information: Franco Izzo et al, Kartläggning av genotyper till kromatintillgänglighetsprofiler i enstaka celler, Nature (2024). DOI:10.1038/s41586-024-07388-y
Journalinformation: Natur
Tillhandahålls av Cornell University