Livets början på jorden och dess utveckling under miljarder år fortsätter att fängsla forskare över hela världen. Den centrala dogmen eller det riktade flödet av genetisk information från en deoxiribosnukleinsyramall (DNA) till ett ribosnukleinsyratranskript (RNA) och slutligen till ett funktionellt protein, är grundläggande för cellulär struktur och funktioner.
DNA fungerar som cellens ritning och bär genetisk information som krävs för syntesen av funktionella proteiner. Omvänt krävs proteiner för syntesen av DNA. Därför, om DNA uppstod först eller protein, fortsätter att förbli en fråga om debatt.
Denna molekylära version av frågan "kyckling och ägg" ledde till förslaget om en "RNA-värld". RNA i form av "ribozymer", eller RNA-enzymer, bär genetisk information som liknar DNA och har också katalytiska funktioner som proteiner.
Upptäckten av ribozymer underblåste ytterligare RNA World-hypotesen där RNA tjänade dubbla funktioner av "genetisk informationslagring" och "katalys", vilket underlättade primitiva livsaktiviteter enbart av RNA. Medan moderna ribosomer är ett komplex av RNA och proteiner, kan ribozymer under tidiga evolutionära stadier ha satts ihop genom sammansättningen av individuella funktionella RNA-enheter.
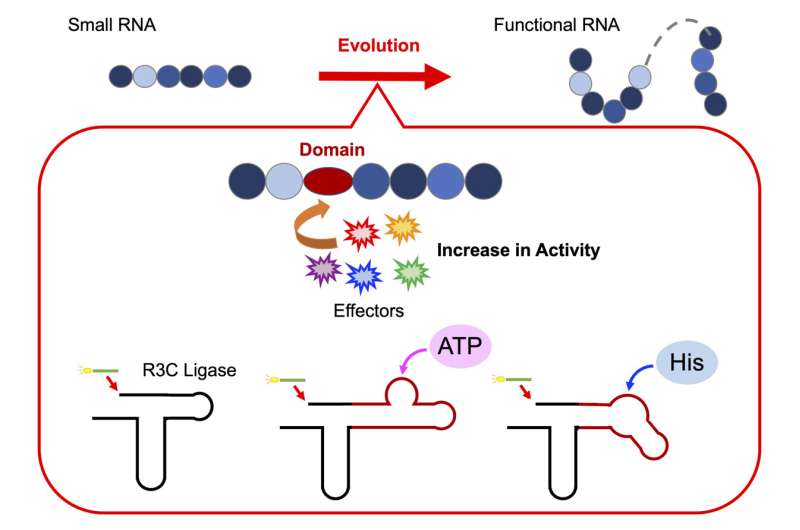
För att testa denna hypotes genomförde professor Koji Tamura tillsammans med sitt team av forskare vid Institutionen för biologisk vetenskap och teknologi, Tokyo University of Science, en serie experiment för att avkoda sammansättningen av funktionella ribozymer. För detta designade de ett artificiellt ribozym, R3C-ligas, för att undersöka hur enskilda RNA-enheter går samman för att bilda en funktionell struktur.
Deras arbete publiceras i tidskriften Life .
Prof. Tamura, som ger ytterligare insikt i deras forskning, säger:"R3C-ligaset är ett ribozym som katalyserar bildandet av en 3',5'-fosfodiesterbindning mellan två RNA-molekyler. Vi modifierade strukturen genom att lägga till specifika domäner som kan interagera med olika effektorer."
Inom ribosomer, som är platsen för proteinsyntes, samlas RNA-enheter för att fungera som peptidyltransferascentra (PTC) på ett sätt så att de bildar en ställning för rekryteringen av aminosyror (individuella komponenter i en peptid/protein) fästa till tRNA. .
Detta är en viktig insikt i proteinsyntessystemens evolutionära historia, men det är inte tillräckligt för att spåra den evolutionära vägen baserad på RNA World-hypotesen.
För att undersöka om förlängningen av RNA, som uppnås genom att länka samman enskilda RNA-enheter, regleras allosteriskt, ändrade forskarna strukturen hos R3C-ligas. De gjorde detta genom att inkorporera korta RNA-sekvenser som binder adenosintrifosfat (ATP), en livsviktig energibärarmolekyl i celler, i ribozymet. Teamet noterade att R3C-ligasaktivitet var beroende av koncentrationen av ATP, med högre aktivitet observerad vid högre koncentrationer av ATP.
Vidare en ökning av smälttemperaturen (Tm värde) visade att bindningen av ATP till R3C-ligas stabiliserade strukturen, vilket sannolikt påverkade dess ligasaktivitet.
På liknande sätt, vid sammansmältning av en L-histidinbindande RNA-sekvens till ribozymet, noterade de en ökning av ligasaktivitet vid ökande koncentrationer av histidin (en nyckelaminosyra). Noterbart var ökningen i aktivitet specifik för ökande koncentrationer av ATP eller histidin; inga förändringar observerades som svar på andra nukleotidtrifosfater eller aminosyror.
Dessa fynd tyder på att ATP och histidin fungerar som effektormolekyler som utlöser strukturella konformationsförändringar i ribozymet, vilket ytterligare påverkar enzymstabilitet och aktivitet.
ATP är den centrala energibäraren i cellen som stöder många molekylära processer, medan histidin är den vanligaste aminosyran som finns i enzymernas aktiva plats och upprätthåller deras syra-baskemi. Med tanke på de viktiga rollerna för ATP och histidin i RNA-interaktioner och molekylära funktioner ger dessa resultat nya insikter om RNA:s roll i tidig evolution, inklusive ursprunget till den genetiska koden.
Dessutom har konstruerade ribozymer som den som utvecklats i denna studie betydande löften i en myriad av tillämpningar, inklusive riktad läkemedelsleverans, terapi, nanobiosensorer, enzymteknik och syntes av nya enzymer med användning i olika industriella processer.
Sammantaget kan denna studie ge insikter i hur övergången från RNA-världen till den moderna "DNA/proteinvärlden" skedde. En grundläggande förståelse av RNA-världen kan i sin tur förbättra deras användning i verkliga tillämpningar.
"Denna studie kommer att leda till klargörandet av processen för 'allostericitetsbaserat förvärv av funktion och kooperativitet' i RNA-evolution. RNA-RNA-interaktionerna, RNA-aminosyrainteraktionerna och allostericiteten som tillämpas i denna forskning kan styra tillverkningen av godtyckliga RNA-nanostrukturer, med olika tillämpningar", avslutar Prof. Tamura.
Mer information: Yuna Akatsu et al, Utveckling av allosteriska ribozymer för ATP och l-Histidin baserat på R3C Ligase Ribozyme, Life (2024). DOI:10.3390/life14040520
Tillhandahålls av Tokyo University of Science