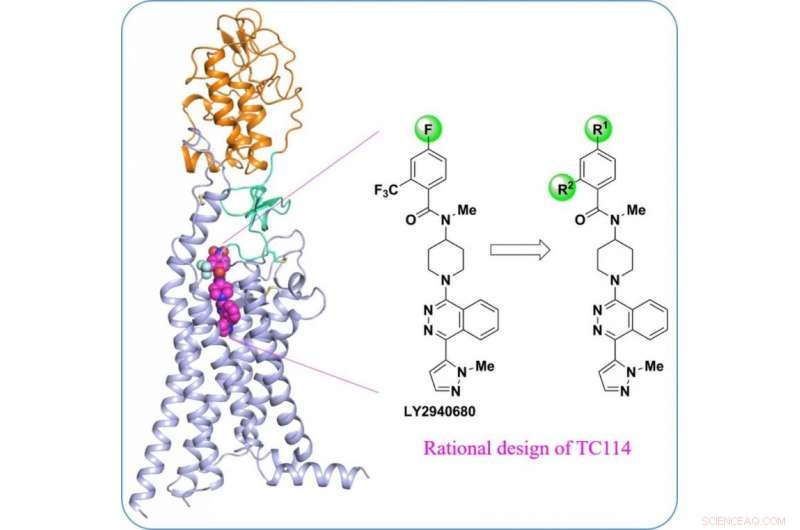
Struktur av multidomän human Smoothened receptor, ett viktigt läkemedelsmål för cancer. Kredit:ShanghaiTech University
Ett team av forskare ledda av iHuman Institute of ShanghaiTech University i samarbete med Fudan University har bestämt den högupplösta kristallstrukturen hos den mänskliga utjämnade multidomänreceptorn. Resultaten illustrerar de allosteriska domän-domäninteraktionerna inom receptorn, och deras roll i utjämnad aktivering. Dessa nya rön publiceras den 17 maj, 2017 in Naturkommunikation , med titeln "Kristallstruktur av en mänsklig utjämnad receptor i flera domäner i komplex med en superstabiliserande ligand, " av Zhang X-J et al.
Som en central aktör i Hedgehog-signalvägen involverad i embryonal utveckling och tumörbildning, den utjämnade receptorn (SMO) har varit länge eftertraktad som ett läkemedelsmål för många cancerformer. Läkemedelsresistens har dock varit ett problem på grund av mutationer i SMO. "Utvecklingen av nästa generations anti-SMO-läkemedel kommer att underlättas genom att förstå multidomänarrangemanget i SMO-strukturen", sa Fei Xu, biträdande professor vid iHuman Institute, ShanghaiTech University, och huvudförfattaren till denna artikel. "Denna struktur kommer att tillåta oss att identifiera potentiellt nya ligandbindningsställen och signalmekanismer."
"För att stabilisera det mänskliga SMO-proteinet med flera domäner, vi designade en serie kemiska verktygsblandningar", sa Houchao Tao, Forskningsdocent vid iHuman Institute. "TC114 är en sond som avsevärt stabiliserar och låser receptorn i en enda konformation." Med ytterligare optimering, Doktoranden Xianjun Zhang löste SMO-strukturen med flera domäner bunden till TC114 vid 2,9 ångström med hjälp av röntgenfri elektronlaser. "Denna struktur avslöjar gångjärnsdomänen som kan spela viktiga modulerande roller för att koppla samman domänerna, ger tips för utvecklingen av nya modulatorer inriktade på denna region", sa Xianjun Zhang.
"Detta är vackert lagarbete", sa Raymond Stevens, chef för iHuman Institute, ShanghaiTech University, "kemi och biologi är överbryggade i denna vetenskap för att förstå strukturen och funktionen hos denna komplexa multidomänreceptor. Kristallstrukturen, i tur och ordning, öppnar nya vägar för läkemedelsupptäckt."