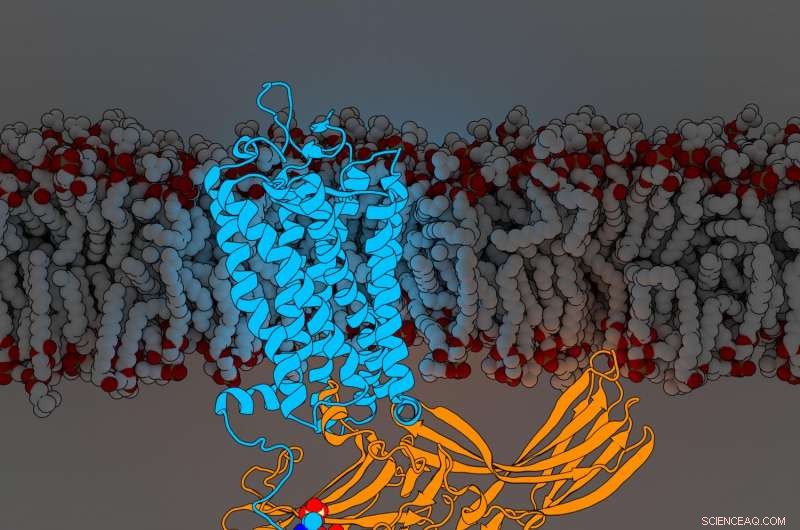
Rhodopsinarrestin. Kredit:Parker de Waal, Xu Laboratory, Van Andel Research Institute
Ett team med forskare från Van Andel Research Institute i spetsen har svarat på en långvarig fråga som kan leda till effektivare läkemedel med färre biverkningar för sjukdomar som sträcker sig från hjärtsvikt till cancer.
Resultaten, publiceras idag i Cell , avslöjar för första gången komponenter i en G-proteinkopplad receptor (GPCR) vid namn rhodopsin bundet till en signalmolekyl som kallas arrestin, båda avgörande delar av kroppens komplicerade cellulära kommunikationsnätverk. Den nya upptäckten förfinar ytterligare ett landmärke 2015 Natur artikel som först beskrev strukturen av de två molekylerna i komplex tillsammans.
"Vår reviderade struktur är som en färdplan med ytterligare detaljer och geografiska egenskaper ifyllda, " sa VARI professor H. Eric Xu, Ph.D., huvudförfattaren till den nya studien samt 2015 års artikel. "I åratal, Fältet har försökt svara på exakt hur arrestiner interagerar med GPCR. Vi hoppas svaret som vårt arbete ger, i samband med rhodopsin, kommer att underblåsa ny forskning och utformningen av bättre mediciner, till den ultimata fördelen för patienter runt om i världen."
GPCR är den största gruppen av cellytreceptorer, och fungera som informationscentraler genom att länka till antingen arrestiner eller andra signalmolekyler som kallas G-proteiner för att vidarebefordra kritiska instruktioner för otaliga biologiska funktioner, inklusive tillväxt och hormonreglering. Dessa egenskaper, i kombination med deras placering på cellens yta, göra dem attraktiva mål för läkemedelsbehandling. Uppskattningsvis 30 procent av alla mediciner som för närvarande finns på marknaden är inriktade på GPCR.
"Eftersom arrestiner och G-proteiner förmedlar olika cellulära svar, att utveckla läkemedel som bara aktiverar en av dessa två vägar kan ge färre biverkningar för patienter, sa Karsten Melcher, Ph.D., senior författare på tidningen och docent vid VARI. "Insikten som tillhandahålls av vår utökade struktur kan gå långt för att vägleda utformningen av dessa terapier."
För att bestämma deras utökade struktur, Xu Lab seniorforskare Edward Zhou, Ph.D., omanalyserade mer än 22, 000 individuella bilder samlade in för den ursprungliga studien 2015 med hjälp av förbättrad programvara som inte var tillgänglig vid tillfället. Den avslöjade tre tidigare dolda molekylära komponenter som kallas fosforylgrupper på rhodopsin och tre motsvarande fickor på arrestin som fungerar som dockningsstationer. Det specifika arrangemanget av dessa fosforylgrupper – kända som fosforyleringskoder – krävs för att rhodopsin ska binda till arrestin, ungefär som kombinationen till ett kassaskåp. När det är klart, denna interaktion initierar en gren av ett komplext cellulärt kommunikationsnätverk som reglerar funktioner i hela kroppen.
"Den stora frågan blev då, "Om detta händer med rhodopsin och arrestin, händer det i alla GPCR?'" sa Parker de Waal, en Van Andel Institute Graduate School-student och medlem i Xus labb. "Våra resultat indikerar att dessa koder - dessa specifika sekvenser av fosforylgrupper - finns helt eller delvis i de flesta GPCR. Fynden hjälper elegant att ta itu med en långvarig fråga inom vårt område; varför vissa GPCR binder arrestiner bättre än andra kan nu förklaras genom förekomsten av fosforyleringskoder."
Ett verktyg för att utforska förekomsten av dessa koder över kommenterade GPCR-data fanns inte, så de Waal skapade en. Dels webb-GUI och del Python-baserat kommandoradsverktyg, PhosCoFinder gjorde det möjligt för teamet att snabbt söka igenom den totala uppsättningen av alla kända GPCR och förutsäga potentiella fosforyleringskoder.
Som förväntat, mer än hälften av de 825 GPCR som skannats av PhosCoFinder visade sig innehålla fosforyleringskoder i sin C-terminala svans, en del av GPCR som hjälper till att överföra information från cellens miljö till insidan av cellen. De flesta av de återstående GPCR:erna visade sig också ha koder; dock, de var belägna i andra områden än deras C-terminala svansar, möjligen påverka sättet de binder till arrestiner. Nästa steg, Xu säger, är att undersöka om dessa fynd stämmer över alla GPCR och andra cellyteproteiner som interagerar med arrestin.
"Med biologi, det finns alltid mer än ett sätt att göra saker på, " Sa Xu. "Vi vill följa de andra vägarna också i hopp om att de hjälper oss att ytterligare förstå dessa kritiska mekanismer."