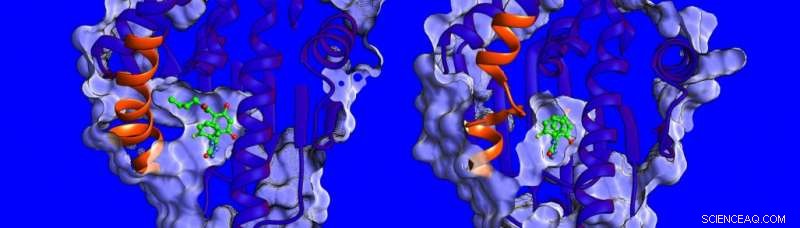
Skillnader i strukturen och dynamiken för den spiralformade regionen (visad i orange) för HSP90-proteinet. Kredit:Heidelberg Institutet för teoretiska studier
En gemensam industri/akademisk studie av ett cancermålprotein avslöjar ett ovanligt samband mellan bindningsställets flexibilitet och läkemedelsmållivslängden. Resultaten, publiceras i Naturkommunikation , föreslå en ny strategi för läkemedelsupptäckt. Forskningen gjordes inom ramen för Kinetics for Drug Discovery K4DD-konsortiet, stöds av Innovative Medicines Initiative.
De flesta läkemedel utövar sin terapeutiska effekt genom att binda till en målproteinmolekyl, därigenom stör proteinets normala funktion. Traditionellt, det har ansetts att ju hårdare ett läkemedel binder sitt målprotein, dvs ju större dess bindningsaffinitet är, desto effektivare blir det. Dock, droger måste fungera i levande organismers ständigt föränderliga miljö. Det är därför alltmer erkänt att inte bara bindningsaffinitet och termodynamik, men även läkemedelsmåluppehållstider och kinetik måste optimeras under processen för läkemedelsupptäckt.
Kinetiken på prov:Att studera ett cancermål
Ett multidisciplinärt team av forskare från K4DD partners Merck KGaA (Darmstadt), Heidelberginstitutet för teoretiska studier (HITS), och Instituto de Biologia Experimental e Tecnológica (iBET) (Lissabon), tillämpade state-of-the-art experimentella och beräkningsmetoder för att undersöka bestämningsfaktorerna för måluppehållstider för en uppsättning hämmare av ett brett studerat cancermål, värmechockprotein 90 (HSP90). HSP90-hämmare kan störa cellcykeln och potentiellt stoppa tumörtillväxt. Teamet publicerade nyligen några av sina resultat i Naturkommunikation .
Överraskande resultat:större rörlighet för bindningsställena leder till längre uppehållstider
"Just nu, det är lite känt om faktorerna som påverkar uppehållstider för läkemedelsmål, så vi bestämde oss för att mäta bindningstermodynamiken och kinetiken, lösa strukturerna för HSP90-inhibitorkomplex och simulera deras dynamik, " säger Dr Marta Amaral, en av motsvarande författare. De strukturer som bestäms av röntgenkristallografi visar att bindningsfickan hos HSP90 är kantad av en region som kan ta formen av en helix eller en loop när den är bunden till olika inhibitorer (se bilden nedan).
Forskarna fann att föreningar som binder med en närvarande helix binder under en längre tid. "Vi blev verkligen förvånade, " säger Prof. Rebecca Wade (HITS), "när vi fick reda på att en viktig bidragande orsak till de långa uppehållstiderna var den större rörligheten i den spiralformade delen av bindningsfickan när inhibitorn band." Denna ovanliga bindningsmekanism öppnar en ny väg för läkemedelsdesign:Forskare kan överväga mindre stela proteinmål och identifiera molekyler som stabiliserar mer rörliga former av proteinet vid bindning - ungefär som en pjäxa med en anpassningsbar innerfoder som ständigt anpassar sig till foten. Resultaten av denna studie föreslår ett nytt sätt att hitta mer effektiva läkemedelskandidater med optimala kinetiska och termodynamiska egenskaper.