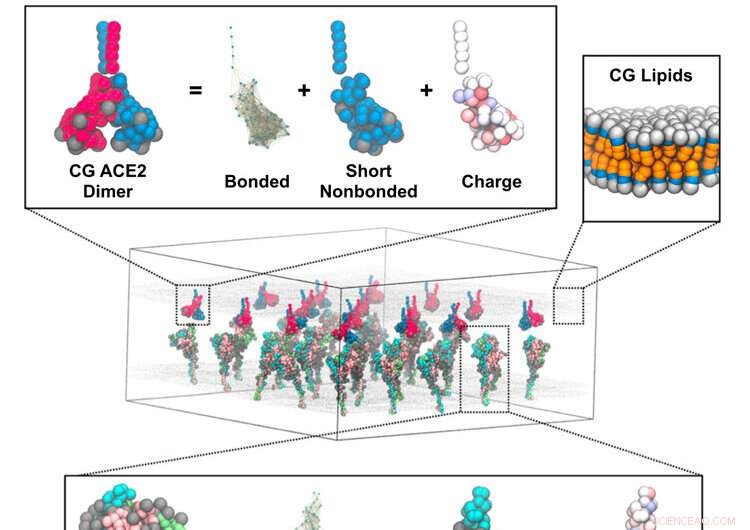
Mekanismen genom vilken koronaviruset smälter samman med värdceller har föreslagits genom simuleringar av forskare vid University of Chicago som använder Frontera superdator vid TACC. Representativ skildring av en kurskornig (CG) simulering av spiktrimerer i membran som interagerar med ett intilliggande membran med ACE2-dimerer. Insättningarna visar CG-modellkomponenterna för spiktrimer (nederst), ACE2-dimer (övre till vänster) och lipidmembran (övre höger). Kredit:Pak, A.J., Yu, A., Ke, Z. et al.
Mysteriet med exakt hur SARS-CoV-2-viruset infekterar mänskliga lungceller förblir till stor del dolt för experimentella forskare. Nu har dock de djävulska detaljerna i mekanismen genom vilken coronaviruset smälter samman med värdceller föreslagits genom simuleringar av forskare från University of Chicago som använder Frontera superdator vid Texas Advanced Computing Center (TACC).
Datormodellerna visar det samverkansbeteende som värdcellreceptorproteiner leder till deras egen infektion. Arbetet kan användas för att hjälpa till att förstå den ökade virulensen hos varianter av coronavirus som delta, omicron och mer.
"Vi upptäckte att spikeproteinet interagerar med två ACE2-receptorer på ett mycket samarbetsfullt sätt", säger Gregory Voth, en framstående professor i kemi vid University of Chicago. "Detta är en grundläggande biofysisk insikt."
Voth är seniorförfattare till studien som modellerade interaktioner mellan coronaviruset och receptorceller med datorsimuleringar publicerade i tidskriften Nature Communications i februari 2022.
Som en fotboll med spikar pryder spikproteinerna ytan av coronaviruset. Spikarna söker upp och smälter samman med proteinreceptorerna för angiotensinomvandlande enzym 2 (ACE2) i mänskliga lungceller. Spikproteinet består av två huvuddelar. S1-domänen innehåller den receptorbindande domänen som känner igen ACE2-proteiner. Och S2-domänen innehåller fusionsmaskineriet, som skyddas och täcks som ett skal av S1-domänen.
Simuleringarna avslöjar hur det ena ACE2-receptorproteinet håller fast vid coronavirusets spik och försvagar den medan den andra börjar dra isär den. S1-domänen faller sedan isär och exponerar fusionsmaskineriet. Denna "ett-två" stans förbereder viruset för fusion och inträde i mänskliga lungvärdceller.
"Det verkar som om varianter som delta och omicron kan accentuera det beteendet ännu mer - det är ett nyckelsteg. I slutändan bör framtida antikroppar och eventuellt molekylära läkemedel kunna störa denna process," sa Voth.
Voth och kollegor utvecklade vad de kallar "bottom-up grovkorniga modeller" som tog kryo-elektrontomografidata från labbet av studiens medförfattare John Briggs från Max Planck Institute of Biochemistry. De kombinerade det med simuleringar av atomistisk molekylär dynamik. Data som genererades matades in i ett teoretiskt ramverk som utvecklade de grovkorniga modellerna.
"De grovkorniga modellerna är upp till 1 000 gånger snabbare än raka simuleringar av atomistisk molekylär dynamik, men de behåller de väsentliga fysiska egenskaperna," sa Voth. Denna metod ger en enorm besparing i tid och pengar på beräkningarna.
Vetenskapsteamet tilldelades superdatorresurser och tjänster av COVID-19 HPC Consortium, en offentlig-privat insats till stöd för covid-19-forskning. Genom konsortiet använde de det National Science Foundation-finansierade Frontera-systemet vid TACC; Witherspoon-datorklustret vid IBM Research; och resurser från Oak Ridge Leadership Computing Facility vid Oak Ridge National Laboratory.
"Vi beräknade all-atom molekylär dynamikdata på Frontera och använde analysverktyg tillgängliga från TACC - båda var mycket värdefulla," sa Voth.
Voths team lämnade in sitt papper innan delta- och omicron-varianterna var kända och förutsade därför inte mutationerna. Men de gick tillbaka och reviderade modellerna för att undersöka varianterna.
"Delta har något som liknar en öppning i spiken som händer lättare än i tidigare mutationer i coronavirus," sa Voth. "Det kändes spännande ur ett vetenskapligt perspektiv att se beteenden som inte setts tidigare."
Voth hänvisade till labbdata från kryoelektronmikroskopi som visar strukturen hos ett lösligt spikprotein med två ACE2-receptorer bundna till det. Men han skiljde detta kristalliserade exempel från vad han undersökte med hjälp av simuleringar i den mer realistiska miljön av många proteiner som interagerar med varandra på membranark.
"Superdatorer, om de används väl och bygger på bra fysik, kan ge ett helt nytt sätt att se på dessa processer. Genom datorsimulering kan man studera saker som för närvarande inte kan göras med experiment. Simulering och experiment fungerar väldigt bra tillsammans, hand i hand," sa Voth. + Utforska vidare