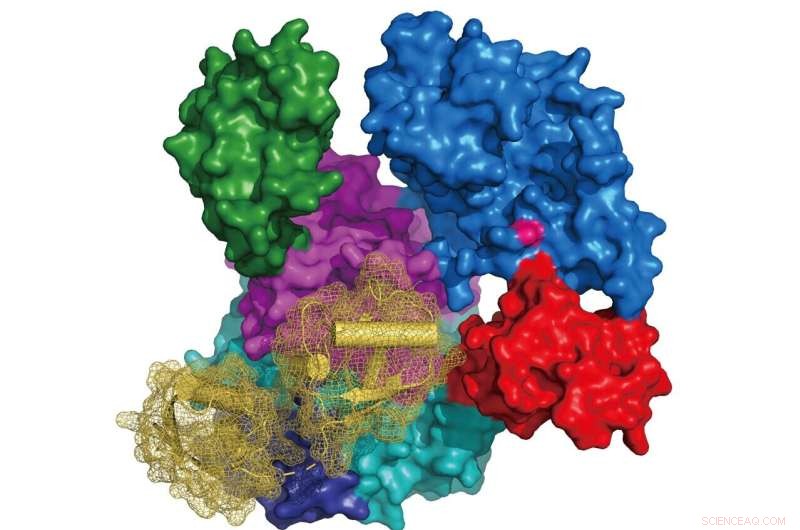
Bild:Struktur av UBA6 (ytrepresentation färgad enligt dess domänarkitektur, aktiv plats cystein i rosa) i komplex med FAT10 (banddiagram i gult med ytrepresentation i mesh). Kredit:Schindelin Group
Forskare vid Rudolf Virchow Center vid universitetet i Würzburg har avslöjat kristallstrukturerna för UBA6 i komplex med antingen ATP eller det ubiquitinliknande proteinet FAT10. Dessa resultat ger grunden för att studera de individuella rollerna för UBA6 mot bindningen av antingen ubiquitin eller FAT10 till målproteiner och de nedströms cellulära vägarna med möjliga implikationer för etiologin hos vissa tumörer. Denna studie publicerades i tidskriften Nature Communications .
Ubiquitylering av målproteiner är en av de viktigaste posttranslationella modifieringarna och spelar väsentliga roller i många cellulära processer. Ubiquitylering utförs av en sekventiell enzymatisk kaskad av E1-aktiverande enzymer, E2-konjugerande enzymer och E3-ligerande enzymer. Under många år ansågs UBA1 vara det enda E1-enzymet som aktiverar ubiquitin, tills 2007 upptäcktes ett andra ubiquitinaktiverande enzym:UBA6.
Ett potentiellt mål för läkemedelsutveckling
UBA6 finns endast hos ryggradsdjur och sjöborrar. Spännande nog är UBA6 ett ovanligt E1-enzym eftersom det aktiverar både ubiquitin och det ubiquitinliknande proteinet (Ubl) FAT10. På grund av dess begränsade utbud av ubiquityleringshändelser, jämfört med verkan av det generiska ubiquitinaktiverande enzymet UBA1, och eftersom det är den enda E1-katalyserande FAT10-bindningen, anses UBA6 vara ett potentiellt läkemedelsmål. För att ytterligare utforska den riktade hämningen av UAB6 är det viktigt att förstå dess dubbla specificitet och identifiera varianter av enzymet som är försämrade i antingen ubiquitin- eller FAT10-aktivering.
Forskargruppen av prof Hermann Schindelin vid Rudolf Virchow Center vid universitetet i Würzburg rapporterar de första strukturerna av UBA6, i komplex med antingen ATP eller FAT10. Intressant nog avslöjade deras struktur- och modelleringsstudier också hur UBA6 tillåter dubbelt igenkänning av ubiquitin och FAT10. Ett annat nyckelfynd är identifieringen av UBA6-varianter som selektivt avskaffar aktiveringen av antingen ubiquitin eller FAT10. "Dessa resultat ger grunden för att studera de individuella rollerna UBA6 spelar i aktiveringen av antingen ubiquitin eller FAT10 i nedströms cellulära vägar", säger Schindelin.
Trasslat i olika sjukdomar
Eftersom ubiquitylering och FAT10ylering är involverade i flera cellulära processer är det inte förvånande att funktionsfel i en eller flera komponenter i detta system leder till en mängd olika sjukdomar. UBA6-medierad proteasomal nedbrytning rapporterades vara involverad i hjärnassocierade fysiologiska och patofysiologiska tillstånd hos möss. Intressant nog visade sig UBA6 vara överuttryckt i mänskliga hjärnor från patienter med Alzheimers sjukdom. Tumörsuppressorproteinet p53 är ett FAT10-substrat och en dubbelnegativ reglering av FAT10 och p53 observerades vara avgörande för kontrollen av tumörbildning, vilket är i linje med överuttrycket av FAT10 i många cancercelltyper.
Även om förutsägelser om orienteringen av ubiquitin i komplex med UBA6 lätt kunde genereras på basis av UBA6-ATP-komplexstrukturen och tillgängliga UBA1-Ub-strukturer, verkade det omöjligt att förutsäga hur FAT10 och i synnerhet dess N-terminala domän ( NTD) skulle interagera med UBA6. Därför var bestämningen av UBA6-FAT10 samkristallstrukturen ett avgörande steg. Baserat på de experimentellt härledda strukturerna och modellen UBA6-ubiquitin-komplex identifierades en selektivitetsväxling som ledde till att den efterföljande upptäckten av UBA6-varianter selektivt avskaffade aktiveringen av någon av modifierarna.
Framtida studier av UBA6 med de selektivt försämrade mutanterna behövs för att undersöka möjliga kopplingar mellan UBA6-katalyserad ubiquitylering och FAT10ylering i samband med cancer. "Om orsakssamband kan fastställas, kommer den riktade hämningen av UBA6 genom enzymatiska och kiselbaserade screeningmetoder att genomföras", förklarar Schindelin. "Med uppsättningen mutaner som selektivt försämrar ubiquitylering eller FAT10ylering kommer vi att undersöka den selektiva försämringen av båda processerna i cellbaserade experiment med särskilt fokus på cancerceller." + Utforska vidare