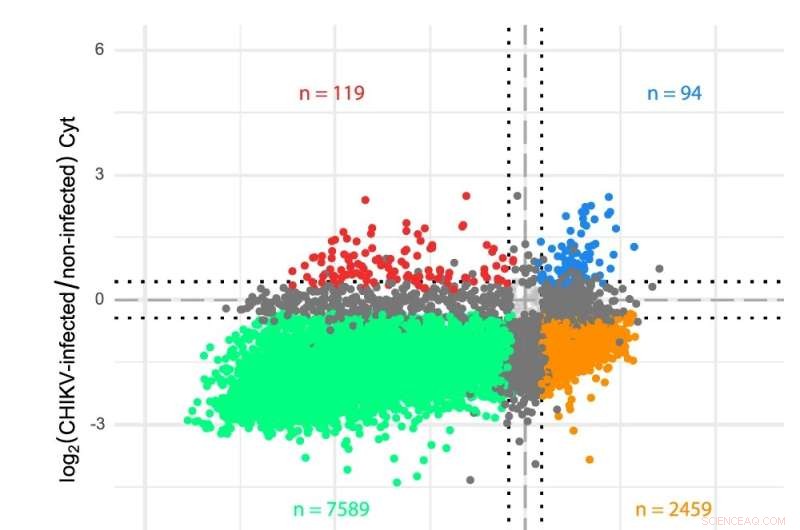
ett schema av CHIKV RNA-genom. b Transkriptomanalyser av cytosol (Cyt) och ER-kompartment i CHIKV-infekterade celler. Gener plottades enligt deras log2-faldiga förändringar i CHIKV-infekterade mot icke-infekterade celler för båda translationsavdelningarna. Sekvenseringsavläsningarna analyserades med en anpassad transkriptomannotering och differentiellt uttryck bestämdes via limma-voom (se Metoder). Färger indikerar gener som är signifikant (FDR < 0,05) nedreglerade i båda avdelningarna (grön), uppreglerade i båda avdelningarna (blå), upp- eller nedreglerade i endast en avdelning (mörkgrå) eller visar motsatt beteende i de två facken (orange och röda). Prickade linjer indikerar log2-faldiga förändringar på ±0,433 (dvs en 35% förändring i endera riktningen) som används som minimigräns för att deklarera mRNA-nivåer som ändrade. HEK 293T-celler infekterades vid en MOI på 4 och prover samlades in tolv timmar efter infektion. Tre oberoende replikat utfördes för varje tillstånd. Kredit:Nature Communications DOI:10.1038/s41467-022-31835-x
Molecular Virology Research Group vid Pompeu Fabra University (UPF), i samarbete med Epitranscriptomics and RNA Dynamics-gruppen vid Center for Genomic Regulation (CRG), har upptäckt en ny mekanism där virus modifierar cellulära maskiner för att bättre läsa instruktionerna i genomet av det invaderande viruset och sålunda producera stora mängder viral avkomma. Studien har publicerats i Nature Communications och leddes av Juana Díez.
Gener innehåller den information som krävs för bildandet av proteiner, komplexa molekyler som är livsnödvändiga, bildade av aminosyror. Läsningen av denna information sker i två huvudsteg, där det första är transkription, där informationen om genen (DNA) överförs till en molekyl som kallas budbärar-RNA (mRNA). mRNA består av en "text" bildad av tripletter av nukleotider (bokstäverna GCT, CAT, etc.). Varje triplett motsvarar en aminosyra. Den andra fasen är translation, där en molekyl som kallas transfer-RNA (tRNA) känner igen varje triplett och fungerar som en översättare genom att ta med motsvarande aminosyra. Proteiner byggs upp via denna process.
Det finns 61 kodon och 20 aminosyror, och så många tripletter kodar för samma aminosyra. Varje organism använder företrädesvis en av dessa tripletter (optimal triplett) eftersom den har en högre koncentration av tRNA som känner igen den tripletten. Sålunda, när "texten" för mRNA:t anrikas med optimala tripletter, kommer proteinerna att genereras snabbt och effektivt, medan när de anrikas i icke-optimala tripletter kommer uttryckets effektivitet att minska eftersom de relaterade tRNA:erna är få.
Virus är väldigt enkla och för att föröka sig och uttrycka sina proteiner måste de kapa värdens cellulära maskineri. Virus genererar sitt eget mRNA i cellerna de infekterar, som de senare läser av och genererar virala proteiner för att producera fler virus. Men mRNA från många virus, inklusive SARS-CoV-2 och virus som överförs av myggor, dengue, zika och chikungunya, är berikade med icke-optimala trillingar och uttrycker fortfarande virala proteiner med stor effektivitet. "För att komma till rätta med detta dilemma har vi använt chikungunyaviruset som modell eftersom dess genom förökar sig i extremt höga nivåer", förklarar Jennifer Jungfleisch och René Böetcher, medförfattare till studien.
"Våra fynd visar för första gången att virus modifierar värd-tRNA för att anpassa värdöversättningsmaskineriet till texten i det virala mRNA:t", säger Marc Talló, också medförfattare till artikeln. "Med andra ord, virusinfektionen inducerar en förändring av språket i cellen, så att den uttrycker virusproteinerna mycket effektivt. Eftersom virala proteiner är avgörande för produktionen av virus, kommer denna förändring i slutändan att vara ansvarig för att generera ett stort antal virus i den infekterade cellen", tillägger han.
"Även om studien har fokuserat på chikungunya-viruset, är vårt förslag att modifiering av tRNA som induceras av virusinfektion är en allmän mekanism följt av många virus", förklarar Juana Díez, professor vid UPF-avdelningen för medicin och biovetenskap.
"Dessutom ger våra resultat en grund för att betrakta tRNA-reglering som ett nytt och lovande terapeutiskt mål för utvecklingen av bredspektrumantivirala medel som är effektiva mot flera virus", avslutar Díez. Studien involverade också forskargruppen som koordinerats av Eva María Novoa vid CRG, och de andra författarna är Gemma Pérez-Vilaró och Andres Merits (Institute of Technology, University of Tartu). + Utforska vidare