
Petar Pajic, UB doktorand i biologiska vetenskaper, förbereder ett salivprov för separation och analys. I den nya studien använde teamet en gelelektroforesteknik för att separera muciner från andra proteiner i saliven hos olika däggdjur. Kredit:Douglas Levere / University at Buffalo
Många hala kroppsvätskor innehåller slem, från slembeläggningssnilarna till saliven i munnen. Så hur utvecklades detta under av biologi?
Hos däggdjur är svaret många gånger, och ofta på ett överraskande sätt, enligt en ny studie om proteiner som kallas muciner. Dessa molekyler har en mängd olika funktioner, men som en familj är de kända som komponenter i slem, där de bidrar till ämnets klibbiga konsistens.
Genom en jämförelse av mucingener i 49 däggdjursarter identifierade forskare 15 fall där nya muciner verkar ha utvecklats genom en additiv process som omvandlade ett icke-mucinprotein till ett mucin.
Forskarna föreslår att var och en av dessa "mucinisering"-händelser började med ett protein som inte var ett mucin. Vid någon tidpunkt fäste evolutionen ett nytt avsnitt på denna icke-mucinbas:en bestående av en kort kedja av byggstenar som kallas aminosyror som är dekorerade med sockermolekyler. Med tiden duplicerades denna nya region, med flera kopior som lades till för att förlänga proteinet ytterligare, vilket gör det till ett mucin.
De fördubblade regionerna, som kallas "upprepningar", är nyckeln till en mucins funktion, säger forskarna vid University at Buffalo Omer Gokcumen och Stefan Ruhl, seniorförfattarna till studien, och Petar Pajic, den första författaren.
Sockerarterna som täcker dessa sektioner sticker ut som borsten på en flaskborste, och de ger mucin den slemmiga egenskapen som är avgörande för många viktiga uppgifter som dessa proteiner utför.
Forskningen kommer att publiceras den 26 augusti i Science Advances.
Flaskor med saliv som samlats in från olika däggdjur, inklusive en gris. Kredit:Douglas Levere / University at Buffalo
"Jag tror inte att det tidigare var känt att proteinfunktion kan utvecklas på detta sätt, från att ett protein får upprepade sekvenser. Ett protein som inte är ett mucin blir ett mucin bara genom att få upprepningar. Detta är ett viktigt sätt som evolution gör slem . Det är ett evolutionärt trick, och vi dokumenterar nu att detta händer om och om igen", säger Gokcumen, Ph.D., docent i biologiska vetenskaper vid UB College of Arts and Sciences.
"De upprepningar vi ser i muciner kallas "PTS-upprepningar" för deras höga innehåll av aminosyrorna prolin, treonin och serin, och de hjälper muciner i deras viktiga biologiska funktioner som sträcker sig från att smörja och skydda vävnadsytor till att göra vår mat hal. så att vi kan svälja det", säger Stefan Ruhl, DDS, Ph.D., provisorisk dekanus vid UB School of Dental Medicine och professor i oral biologi. "Välgörande mikrober har utvecklats för att leva på slembelagda ytor, medan slem samtidigt också kan fungera som en skyddande barriär och försvara mot sjukdomar genom att skydda oss från oönskade patogena inkräktare."
"Det är inte många som vet att det första mucinet som hade renats och biokemiskt karakteriserats kom från en spottkörtel," tillägger Ruhl. "Mitt labb har studerat muciner i saliv under de senaste 30 åren, mest för att de skyddar tänderna från förfall och för att de hjälper till att balansera mikrobiotan i munhålan."
The intriguing evolution of an 'amazing life trait'
"I think this paper is really interesting," Gokcumen says. "It's one of those times where we got lucky. We were studying saliva, and then we found something that's interesting and cool and decided to look into it."
While studying saliva, the team noticed that a small salivary mucin in humans called MUC7 was not present in mice. The rodents did, however, have a similarly sized salivary mucin called MUC10. The scientists wanted to know:Were these two proteins related from an evolutionary perspective?
The answer was no. But what the research uncovered next was a surprise. While MUC10 did not appear to be related to MUC7, a protein found in human tears called PROL1 did share a portion of MUC10's structure. PROL1 looked a lot like MUC10, minus the sugar-coated bottlebrush repeats that make MUC10 a mucin.
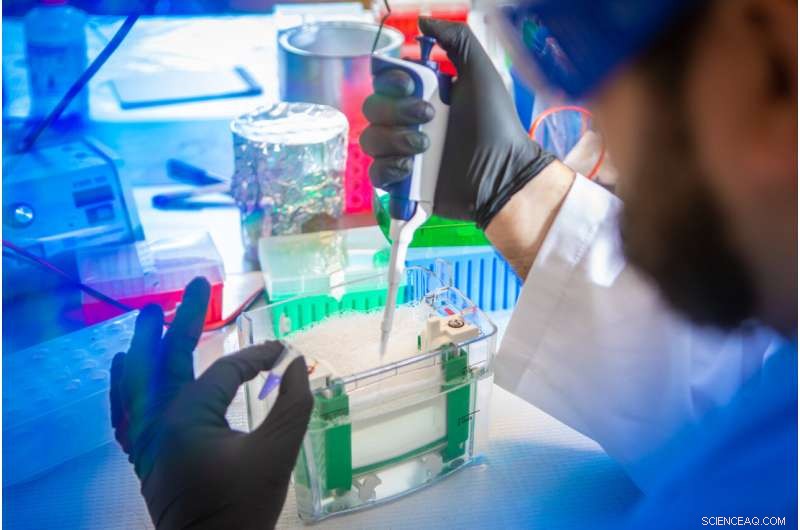
Petar Pajic, UB PhD student in biological sciences, uses a gel electrophoresis technique to separate mucins from other proteins in a saliva sample. Credit:Douglas Levere / University at Buffalo
"We think that somehow that tear gene ends up repurposed," Gokcumen says. "It gains the repeats that give it the mucin function, and it's now abundantly expressed in mouse and rat saliva."
The scientists wondered whether other mucins might have formed the same way. They began to investigate and discovered multiple examples of the same phenomena. Though many mucins share common ancestry among various groups of mammals, the team documented 15 instances in which evolution appeared to have converted non-mucin proteins into mucins via the addition of PTS repeats.
And this was "with a pretty conservative look," Gokcumen says, noting that the study focused on one region of the genome in a few dozen mammal species. He calls slime an "amazing life trait," and he's curious whether the same evolutionary mechanism might have driven the formation of some mucins in slugs, slime eels and other critters. More research is needed to find an answer.
"How new gene functions evolve is still a question we are asking today," says Pajic, a UB Ph.D. student in biological sciences. "Thus, we are adding to this discourse by providing evidence of a new mechanism, where gaining repeated sequences within a gene births a novel function."
"I think this could have even broader implications, both in understanding adaptive evolution and in possibly explaining certain disease-causing variants," Pajic adds. "If these mucins keep evolving from non-mucins over and over again in different species at different times, it suggests that there is some sort of adaptive pressure that makes it beneficial. And then, at the other end of the spectrum, maybe if this mechanism goes 'off the rails'—happening too much, or in the wrong tissue—then maybe it can lead to disease like certain cancers or mucosal illnesses."
The study on mucins demonstrates how a long-time partnership between evolutionary biologists and dental researchers at UB is yielding new insights into genes and proteins that are also important to human health.
"My team has been studying mucins for many decades, and my collaboration with Dr. Gokcumen has brought this research to a new level by revealing all these exciting novel insights into their evolutionary genetics," Ruhl says. "At this advanced stage of my career, it is also immensely gratifying to see that the flame of scientific curiosity is being carried on by a new generation of young investigators like Petar Pajic." + Utforska vidare