Att hålla den genetiska informationen som lagras i genomiskt DNA intakt under celldelningscykeln är avgörande för nästan alla livsformer. Omfattande DNA-skador orsakar undantagslöst olika negativa genomiska omarrangemang, vilket kan leda till celldöd i de bästa fallen och till uppkomsten av sjukdomar som cancer i de värsta fallen.
Lyckligtvis delar celler i livets alla tre domäner en speciell felfri mekanism för att upprätthålla genetisk information, känd som homolog rekombination (HR).
Processen med HR startar när en cell stöter på DNA-skada under DNA-syntes eller efteråt, vilket initierar en kaskad av händelser. Det skadade DNA:t resekeras eller skärs först för att skapa enkelsträngade ändar nära den skadade platsen. Dessa ändar matchas sedan till sin motsvarande region i en tillgänglig replikerad kromosom, även känd som "systerkromatid", som i huvudsak används som en mall för att reparera det skadade DNA:t.
Som man kan förvänta sig involverar HR-vägen en myriad av proteiner och cellulära maskiner. Medan de flesta av dessa proteiner och cellulära maskiner är väl studerade, förblir några av dem något gåtfulla. Så är fallet med regulatorerna av RAD51, ett protein som ansvarar för att reparera dubbelsträngsbrott i DNA.
Normalt bildar RAD51 filament som hjälper till att bevara DNA-replikationsgafflar - övergående arrangemang av DNA som ofta uppstår under DNA-replikation, som vid replikationsgaffelkollaps. Korrekt reglering av RAD51, såväl som nedbrytningen av dessa filament efter att deras syfte har fyllts, är avgörande för HR.
De exakta mekanismerna genom vilka onormal RAD51-ackumulering leder till genetisk instabilitet är dock inte helt klarlagda, och många positiva och negativa RAD51-regulatorer förblir oklara.
Nu däremot i en nyligen publicerad artikel i Nucleic Acid Research den 10 april 2024 undersökte ett forskarlag under ledning av professor Miki Shiinoara från Institutionen för avancerad biovetenskap, Kindai University, Japan, det nära förhållandet mellan RAD51 och FIGNL1, en av dess viktigaste regulatorer. Studien var medförfattare av Kenichiro Matsuzaki, även han från Institutionen för avancerad biovetenskap, Kindai University, och kastar lite välbehövligt ljus över HR-processen.
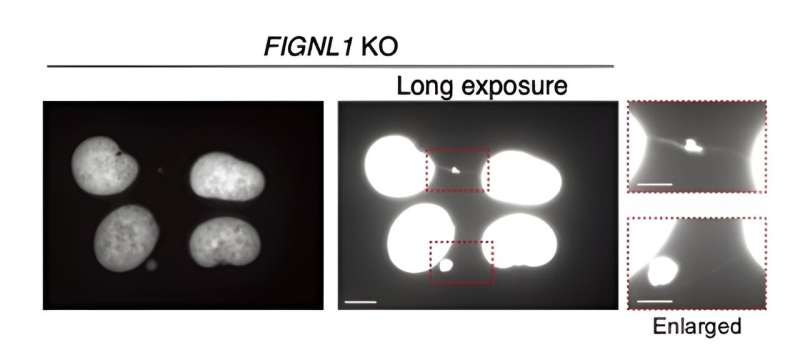
Först genmanipulerade forskarna mänskliga celler som inte uttryckte FIGNL1 (det vill säga FIGNL1 KO-celler), med den väletablerade CRISPR/Cas9-metoden. Sedan, med hjälp av avancerade immunfärgningstekniker som involverade noggrant utvalda antikroppar och fluorescensmikroskopi, visualiserade de HR-processen i detalj och letade efter indikatorer på abnormiteter.
Genom att kombinera detta tillvägagångssätt med en uppsjö av andra experimentella procedurer, såsom western blotting, cellcykelanalys, proteinanalyser och genomiska och transkriptomiska analyser, lyckades de få en heltäckande bild av vad som händer i en cell när FIGNL1 saknas.
Resultaten avslöjar att FIGNL1 är ett mycket specialiserat RAD51-demonteringsenzym som är nödvändigt för korrekt kromosomseparation efter att replikationsgafflarna "demonterats".
Närmare bestämt, när RAD51-filament inte är helt demonterade, inträffar onormala händelser under mitos som producerar olösta mellanprodukter. Detta leder i slutändan till bildandet av så kallade "kromosombryggor" mellan systerkromatiderna. Dessa ultrafina strukturer är mycket skadliga för cellens normala funktion och orsakar spridning av katastrofal genetisk information.
Att förstå de finare detaljerna i HR-vägen, dess nyckelspelare och dess många delprocesser är oerhört viktigt, inte bara ur ett biologiskt perspektiv, utan också ur en medicinsk synvinkel.
"Celldöd på grund av dysreglering av HR är en viktig mekanism genom vilken anticancerläkemedel uppvisar cancercellsspecifik cytotoxicitet", förklarar Prof. Shinohara. "Tills nu har huvudmålet varit HR-aktiveringsbrist, men resultaten av denna studie visar att ihållande aktivering av RAD51 också uppvisar cytotoxicitet och kan vara ett molekylärt mål för läkemedel mot cancer."
Dessutom kan det cellulära maskineriet som är involverat i HR-vägen utnyttjas som ett kraftfullt bioteknikverktyg.
"HR är ett välbevarat system bland de flesta arter och är också tätt kopplat till genmodifieringsteknologier, såsom genomredigering och geninriktningsteknologier," kommenterar Prof. Shinohara, "Sålunda belyser mekanismerna som kontrollerar rekombinasaktivitet, som att av RAD51, kan bidra till att öka effektiviteten av genmodifieringstekniker."
Värt att notera är genteknik en mycket effektiv väg för att öka skörden och för att anpassa mikrobiella organismer för uppgifter som biosanering, som tar itu med olika moderna världsproblem.
Sammantaget belyser resultaten av denna studie inte bara en universell biologisk process utan banar också vägen mot en bättre förståelse av cellulära mekanismer för viktiga läkemedelsupptäckter och framsteg inom området genteknik.
Mer information: Kenichiro Matsuzaki et al, Human AAA+ ATPase FIGNL1 undertrycker RAD51-medierad ultrafin brobildning, Nucleic Acids Research (2024). DOI:10.1093/nar/gkae263
Journalinformation: Nukleinsyraforskning , Nukleinsyraforskning
Tillhandahålls av Kindai University