Yale-forskare har avslöjat nya detaljer om hur bakterier som E. coli bygger sina skyddande barriärer, vilket kommer att informera om ny antibiotikautveckling.
Antibiotikaresistenta bakterier är ett växande problem när det gäller att bekämpa infektioner. Bakterier som har ett extra skyddande lager på sina cellväggar – en typ som kallas "Gram-negativa" med hänvisning till färgningsmetoden som används för att identifiera den – är särskilt svåra att bekämpa.
Yale-forskare har gjort framsteg med att förstå hur bakterier genererar detta skyddande lager genom en ny studie som avslöjar ytterligare nyanser – och ytterligare mål för att utveckla nya antibiotika.
Deras resultat publicerades den 18 april i Proceedings of the National Academy of Sciences .
En kritisk komponent i detta skyddande lager är en molekyl som kallas lipopolysackarid (LPS). Bakterier behöver en viss mängd LPS; för mycket eller för lite dödar cellen. Tidigare forskning från labbet av Wei Mi, biträdande professor i farmakologi vid Yale School of Medicine, avslöjade hur molekylära sensorer i E. coli uppnår rätt balans mellan LPS-produktion.
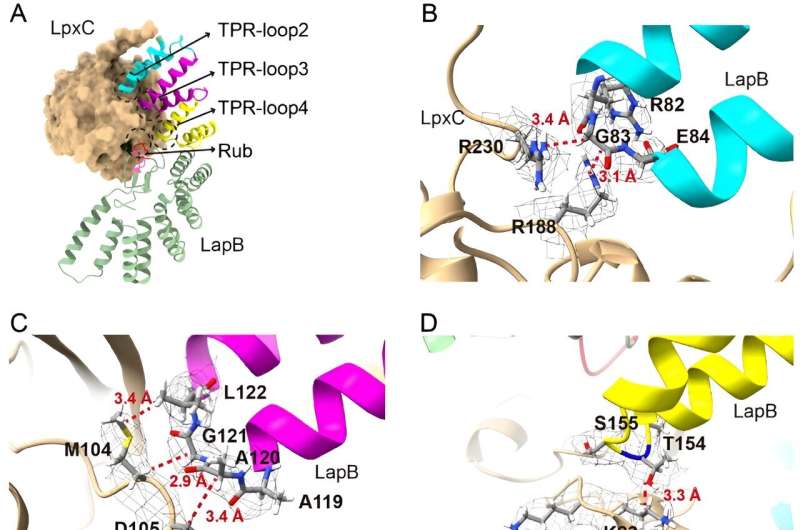
I den nya studien grävde forskare djupare in i den del av denna process som förhindrar överskott av LPS-uppbyggnad, i syfte att klargöra hur ett protein som kallas LapB binder till och stimulerar nedbrytningen av LpxC, ett enzym som sätter igång LPS-produktionen. Forskarna använde kryogen elektronmikroskopi för att se strukturen hos komplexet som skapas när dessa två molekyler binder.
"Att titta på strukturen ger den mest direkta visualiseringen av hur denna del av processen sker", säger Mi, senior författare till den nya studien. "När vi såg strukturen gjorde vi ändringar i molekylerna för att se hur det påverkade bindningen, vilket gjorde att vi kunde identifiera vilka komponenter som är nödvändiga för att LapB ska känna igen LpxC."
Men forskarna fann också, till sin förvåning, att LapB hade en andra roll. Det är inte bara ansvarigt för nedbrytningen av LpxC, utan det hämmar också enzymets verkan innan nedbrytningen sker.
"I grund och botten stänger LapB ner LpxC innan den slänger den", sa Mi. "Vi förstår inte varför bakterier gör detta, eftersom det verkar överflödigt, men det här är vad vi tittar på nu."
Forskarna spekulerar i att denna dubbla roll kan handla om flexibilitet. Nedbrytning är en långsam men irreversibel process, medan hämning är snabb och reversibel. Att ha båda funktionerna kan göra det möjligt för bakterier att reagera på miljöförändringar på ett smidigare sätt.
"Detta är allt relevant för antibiotikautveckling," sa Mi. "Dessa detaljer kommer att hjälpa oss att hitta nya tillvägagångssätt och förstå varför andra inte fungerar."
Mer information: Sheng Shu et al, Dual function of LapB (YciM) för att reglera Escherichia coli-lipopolysackaridsyntes, Proceedings of the National Academy of Sciences (2024). DOI:10.1073/pnas.2321510121
Journalinformation: Proceedings of the National Academy of Sciences
Tillhandahålls av Yale University