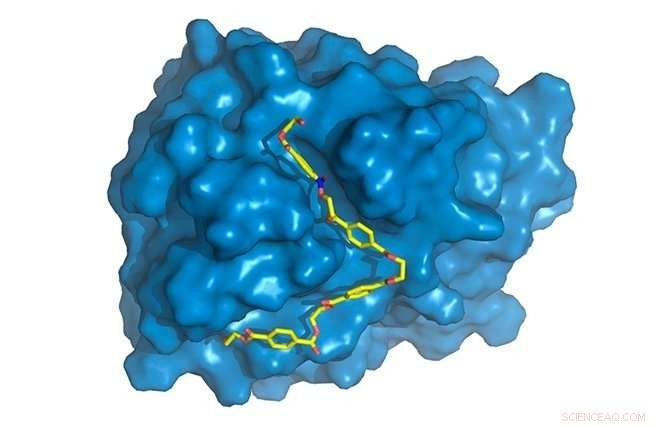
PETase visas i blått, med PET -kedja (gul) bunden till aktiv plats, där det kommer att försämras. Upphovsman:Rodrigo Leandro Silveira
Sedan det upptäcktes, enzymet som kallas PETase har väckt ett stort vetenskapligt intresse för dess förmåga att smälta PET (polyetentereftalat).
En polymer som huvudsakligen används för att tillverka drinkflaskor (men också kläder, mattor, och andra produkter), PET har nackdelen med motståndskraft mot nedbrytning. Flaskor och andra föremål av PET (polyetentereftalat) tar minst 800 år att biologiskt nedbrytas på deponier eller i havet. Mellan 4,8 miljarder och 12,7 miljarder kilo plast dumpas i haven varje år.
En studie med resultat som nyligen publicerats i tidskriften Förfaranden från National Academy of Sciences ( PNAS ) visade hur ett internationellt team av samarbetspartners lyckades öka PETases förmåga att bryta ner plast.
"I vårt forskningsprojekt, vi kännetecknade den tredimensionella strukturen hos enzymet som kan smälta denna plast, konstruerade den för att öka dess nedbrytningskapacitet, och visade att det också verkar på polyeten-2, 5-furandikarboxylat (PEF), ett PET -substitut tillverkat av förnybara råvaror, "sa medförfattaren Rodrigo Leandro Silveira, en postdoktor vid University of Campinas Chemistry Institute (IQ-UNICAMP).
En bakterie som överlever metaboliserande PET
Intresset för PETase uppstod 2016, när en grupp japanska forskare under ledning av Shosuke Yoshida identifierade en ny bakterieart, Ideonella sakaiensis, som kan livnära sig på PET genom att använda det som källa till kol och energi. Bakterien är fortfarande den enda kända organismen med denna förmåga. Det växer bokstavligen på PET.
"Förutom att identifiera I. sakaiensis, de japanska forskarna upptäckte att det producerar två enzymer och utsöndrar dem i miljön, "Silveira förklarade." Ett av enzymerna som utsöndras är PETase. Eftersom den har en viss kristallinitet, PET är en polymer som är mycket svår att bryta ner. Men PETase angriper det och bryter ner det i små enheter av mono (2-hydroxietyl) tereftalsyra, eller MHET. Enheterna av MHET omvandlas sedan till tereftalsyra och absorberas och metaboliseras av bakterien. "
I. Sakaiensis är den enda levande organismen som är känd för att använda en syntetisk molekyl tillverkad av människor för att överleva. Det betyder att bakterien är resultatet av en mycket ny evolutionär process som har utvecklats under de senaste decennierna. Bakterien har anpassat sig till en polymer som utvecklades i början av 1940 -talet och först började användas i industriell skala på 1970 -talet. PETase är nyckeln till att förstå hur.
"PETase gör det svåraste, som bryter ner kristallstrukturen och depolymeriserar PET till MHET, "sa den FAPESP-finansierade forskaren." Det arbete som utförs av det andra enzymet, som omvandlar MHET till tereftalsyra, är mycket enklare, eftersom dess substrat består av monomerer som enzymet lätt kan komma åt eftersom de är dispergerade i reaktionsmediet. Av denna anledning, forskning har fokuserat på PETase. "
Modifierat enzym binder bättre med polymer
Nästa steg var att studera PETase i detalj, bidraget från det nya forskningsprojektet. "Vi fokuserade på att ta reda på vad som ger PETase förmågan att göra något andra enzymer inte kan göra mycket effektivt. Vi började med att karakterisera 3D-strukturen för detta protein, "Silveira förklarade.
"Att få 3D-strukturen innebär att upptäcka x, y- och z -koordinaterna för var och en av de tusentals atomer som utgör makromolekylen. Våra brittiska kollegor gjorde detta med hjälp av en välkänd och allmänt använd teknik som kallas röntgendiffraktion tillgänglig på ett laboratorium som liknar Sirius, nu under uppbyggnad i Campinas. "
När de väl hade fått 3D-strukturen, forskarna började jämföra PETase med relaterade proteiner. Närmaste släkting är ett cutinas av bakterien Thermobifida fusca som bryter ned cutin, ett slags naturligt lack som finns på växternas löv. Vissa patogena mikroorganismer använder cutinas för att bryta ned cutinbarriären och lämpliga näringsämnen i löv.
"Vi hittade vissa specifika skillnader i PETase jämfört med cutinas i regionen av enzymet där de kemiska reaktionerna sker, känd som den aktiva platsen. PETase har en mer öppen aktiv plats, till exempel, "Silveira sa." Vi studerade enzymets molekylrörelser genom datasimuleringar, den del som jag bidragit mest till. Medan kristallstruktur, erhålls genom röntgendiffraktion, lämnat statisk information, simuleringar gav oss dynamisk information och gjorde det möjligt för oss att upptäcka varje aminosyras specifika roll i PET -nedbrytningsprocessen. "
Fysiken för molekylens rörelser beror på elektrostatisk attraktion och avstötning av många atomer och från temperatur. Datorsimuleringar gjorde det möjligt för forskarna att mer fullständigt förstå hur PETase binder och interagerar med PET.
"Vi upptäckte att PETase och cutinase har två olika aminosyror på den aktiva platsen. Vi använde sedan molekylärbiologiska procedurer för att producera mutationer i PETase med syftet att omvandla det till cutinas, Sa Silveira.
"Om vi kunde göra det, vi skulle ta reda på vilka komponenter som gav den denna unika egenskap att nedbryta PET. Dock, till vår förvåning, när vi försökte undertrycka just denna aktivitet av PETase - genom att försöka omvandla PETase till cutinas - producerade vi ett ännu mer aktivt PETas. Vi försökte minska dess aktivitet, och istället förstärkte vi det. "
Fler datorsimuleringar krävdes för att förstå varför det mutanta PETaset var bättre än det ursprungliga PETaset. Modellering och simuleringar visade tydligt att de förändringar som producerades i det ursprungliga PETas underlättade enzymets bindning till substratet. Denna bindning beror både på geometri, med två molekyler som passar ihop som nyckel och nyckelhål, och på de termodynamiska faktorer som är involverade i interaktionerna mellan de olika komponenterna i enzymet och polymeren. Det eleganta sättet att beskriva detta är att det modifierade PETas har "större affinitet" för substratet.
När det gäller att få ett enzym som kan smälta massor av plastavfall, studien var en stor framgång, men varför PETase är PETase förblir ett mysterium.