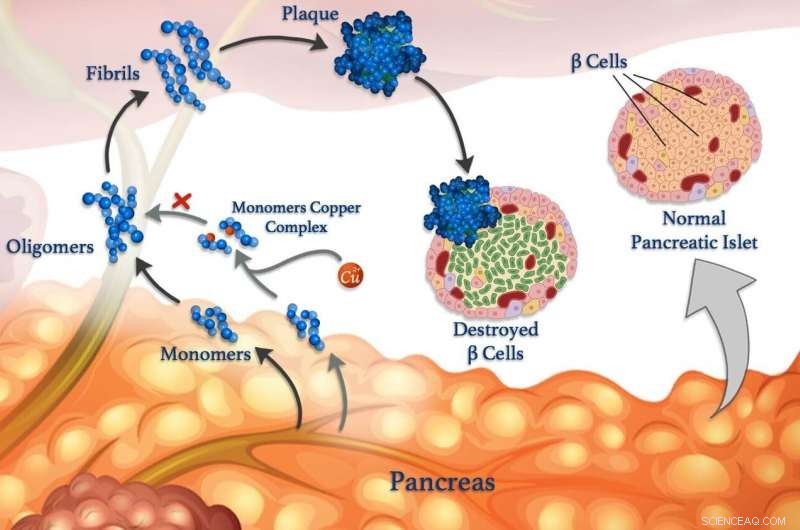
Kopparjoner (röda sfärer) kan fästa vid peptidmonomerer (blå) och förhindra att de klumpar sig samman för att bilda oligomerer, fibriller och skadliga plack. © 2020 Mawadda Alghrably
Upplösning av interaktioner mellan metalljoner och peptider i kroppen kan så småningom leda till förbättrade behandlingar för diabetes, Alzheimers och andra sjukdomar. Att förstå dessa interaktioner är forskningens fokus, ledd av KAUST, det avslöjar hur metaller, som koppar, kan påverka bildandet av skadliga klumpar av felveckade peptidkluster som kallas fibriller, som ligger till grund för många sjukdomar.
Felaktiga peptider är kopplade till neurologiska tillstånd som Alzheimers, samt blodsockerkontrollsjukdom diabetes. Blodsockernivåerna regleras normalt via peptidhormoner som frigörs av specialistceller som kallas β-celler. Förutom insulin, friska β-celler frigör också amylin, ett peptidhormon som hjälper till att minska spikarna i blodsockernivån efter att ha ätit genom att bromsa magtömningen. Men amylin är benäget att bilda felvikna klumpar, särskilt i närvaro av kopparjoner, som skadar β-celler och bidrar till typ II-diabetes.
Dock, metalljoner kan också motverka peptidaggregation under vissa omständigheter, säger KAUST -forskare, Mariusz Jaremko, som ledde arbetet i samarbete med forskare från universitetet i Wroclaw i Polen. För att studera processen mer i detalj, laget undersöker interaktionen mellan koppar (II) joner och amylin och dess molekylära analoger. "Sådan kunskap skulle ge oss inblick i de molekylära mekanismerna för typ II -diabetes, gör det möjligt för oss att utforma nya strategier och behandlingar mot denna sjukdom, "Säger Jaremko.
I deras senaste arbete, laget studerade kopparjonernas inflytande på aggregeringen av två analoger av humant amylin:ett läkemedel som efterliknar amylin som kallas pramlintid och amylin från råttor. "Vi fann att skillnader i strukturerna för pramlintid och råttamylin innebär att kopparjoner hindrar aggregering av pramlintid, men inte råttamylin, "säger Mawadda Alghrably, en doktorsexamen student i Jaremkos team.
Forskarna undersökte processen med hjälp av flera tekniker, inklusive kärnmagnetisk resonans (i samarbete med Abdul-Hamid Emwas från KAUST CoreLabs), och en "tioflavin T" fluorescensanalys av proteinaggregation. De fann att även om båda amylinanalogerna binder koppar, pramlintid kan binda det på två olika sätt på grund av en extra kopparbindande histidinaminosyra som finns i pramlintid men inte råttamylin. Koppar-jonbindning till detta histidin förklarade förmodligen varför koppar minskade pramlintidaggregationen men inte råttamylinaggregationen, forskarna avslutade.
Teamet fortsätter att dechiffrera den molekylära grunden för amylinaggregation, Alghrably säger. "Förstå hur dessa molekyler beter sig, i slutändan kan hjälpa till att underlätta utformningen av nya effektiva läkemedel och behandlingar för typ II -diabetes, " hon säger.