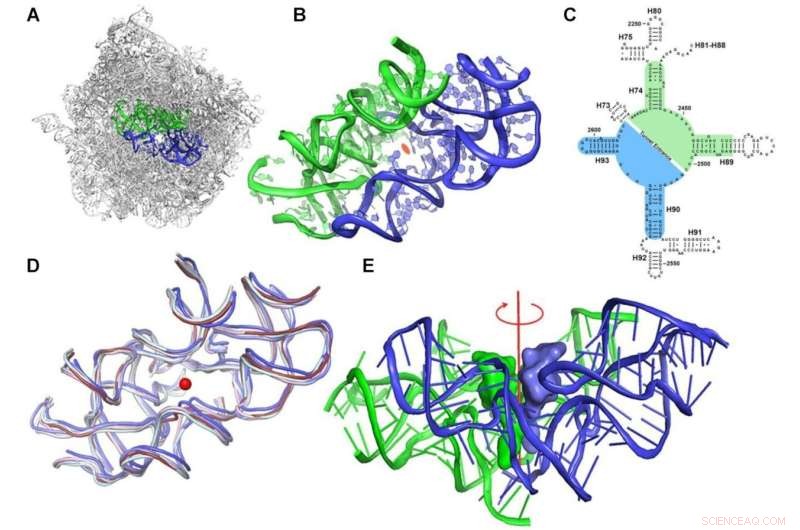
Protoribosomkonceptet. (A) Den symmetriska regionen, markerad i blått (A-reg) och grönt (P-reg), inom rRNA-ställningen av den stora ribosomala subenheten av D. radiodurans (PDBID 1NKW). (B) En närbild av protoribosomen där de tvåfaldiga semisymmetriska delarna visas. Vyn är längs den pseudosymmetriska 2-faldiga axeln. Mitten av PTC markeras med en orange ellips. (C) Ett tvådimensionellt strukturdiagram av rRNA som omger PTC som visar symmetrin. A- och P-reg-nukleotiderna är markerade med hjälp av blå respektive grön bakgrund. 23S rRNA-helixnummer är markerade med svarta etiketter. Nukleotidnumrering enligt E. coli visas. (D) Överlagring av den symmetriska regionen av ribosomstrukturer från olika organismer representativa för olika fylogenetiska klasser:bakteriell (D. radiodurans och E. coli i skiffer respektive ljusblå), jäst (S. cerevisiae i blek cyan), parasit ( L. donovani i blått) och mänskliga ribosomer (cytosoliska och mitokondriella i rubin respektive ljusrosa) (PDBID som används är:1NKW, 4V4Q, 4V7R, 3JCS, 4U60 respektive 3J7Y). Den centrala röda punkten representerar positionen för den förmodade symmetriaxeln, som är vinkelrät mot planet. (E) CCA-3'-änden av A-ställe och P-ställe tRNA överlagrades på den symmetriska regionen av den bakteriella ribosomen (PDBID 1NKW). Vyn är vinkelrät mot den semisymmetriska 2-faldiga axeln, visad i rött. Kredit:Nucleic Acids Research (2022). DOI:10.1093/nar/gkac052
Den här historien börjar för flera miljarder år sedan. Det finns bara kemi, ingen biologi - det vill säga massor av kemiska föreningar finns på jorden, men liv har ännu inte uppstått. Sedan, bland myriader av slumpmässigt självmonterade kemiska strukturer, visar sig en liten RNA-molekylär maskin som perfekt lämpad för att skapa bindningar mellan aktiverade aminosyror, byggstenarna i framtida proteiner.
Det är en vändpunkt i historien om vår planet:syntesen av proteiner, biologiska molekyler som är nödvändiga för livet, kan nu börja. Prof. Ada Yonath och hennes team vid Weizmann Institute of Science tror att de har återskapat det ögonblicket i labbet och visat hur det kan ha hänt. När det gäller den ursprungliga peptidbindningsmaskinen upptäckte de att den fortfarande finns i praktiskt taget varje cell av alla levande organismer, från bakterier till växter och djur, inklusive oss själva.
Teorin bakom teamets projekt föddes för cirka 20 år sedan ur häpnadsväckande fynd som gjordes i Yonaths labb under loppet av att fastställa strukturen och funktionen hos ribosomen – forskning som senare skulle ge henne 2009 års Nobelpris i kemi. Ribosomen utför en av livets kärnprocesser:att tillverka proteiner baserat på informationen i DNA.
"Vi upptäckte en överraskande funktion i strukturen av denna proteintillverkningsmaskin", säger Dr. Anat Bashan, en senior forskare vid Yonaths labb på Weizmanns avdelning för kemisk och strukturell biologi. "Ribosomen är en enorm makromolekyl som inte alls är symmetrisk; i sitt hjärta innehåller den två semisymmetriska element sammanfogade för att bilda en ficka."
Yonath säger att de "blev särskilt slagna av det faktum att denna ficka finns i ribosomerna hos alla organismer. Och det är här all handling äger rum - det är där alla peptidbindningar som skapar kedjan av länkade aminosyror som utgör ett protein Det är därför detta grundläggande maskineri verkar ha bestått oförändrat under hela evolutionen."
Möt protoribosomen:Det är vad forskarna kallar denna fickliknande struktur. De antog att protoribosomen är förfadern till alla moderna ribosomer, en gammal maskin som går tillbaka till prelife-perioden. I jämförelse med cellens storlek är protoribosomen ganska liten. Den består av RNA-molekyler som omfattar cirka 120 nukleotider, cirka 60 för var och en av dess två semisymmetriska komponenter, vilket står för mindre än 5 procent av den moderna ribosomens dimensioner:cirka 4 500 nukleotider i bakterier och nästan 6 000 i människor
Så här utvecklades scenariot, enligt Yonath och hennes team:
Protoribosomen kom till när ett gäng RNA-nukleotidkedjor som självmonterades i två semisymmetriska väggar kopplades ihop för att skapa en ficka. Oändliga andra strukturer måste av misstag ha sammansatts av sig själv ungefär samtidigt, men protoribosomen överlevde och "blev viral", verkar det som, eftersom den utförde användbara funktioner och, tack vare RNA:s inneboende förmåga, kunde den replikera sig själv.
När två aktiverade aminosyror råkade interagera med varandra i denna ficka, bildade de en bindning, vilket underlättades av de rådande kemiska förhållandena. De aminosyrorna kan ha uppstått på jorden eller, som vissa hävdar, landat med asteroider från yttre rymden, men deras ursprung är irrelevant för vår berättelse. Det som spelar roll är att inom protoribosomen kan två aktiverade aminosyror binda till varandra. Senare förenade sådana bindningsskapande många fler aminosyror och länkade dem till en kedja.
Det var början på proteiner, av vilka några sedan visade sig användbara för att stabilisera och stärka själva protoribosomen. Proteinerna fortsatte att lägga till protoribosomens struktur, vilket gjorde det möjligt för den att utvecklas till den sofistikerade proteintillverkningsfabrik den är idag. "En modern ribosom kan beskrivas som en lök, med protoribosomen i centrum, omgiven av fler lager som lades till under evolutionen", säger Yonath.
Med tiden skulle proteinproduktionen bli tillräckligt effektiv för att skapa kedjor upp till tusentals aminosyror i längd, och att göra det enligt instruktionerna i den genetiska koden. De tiotusentals proteinerna i människokroppen utför alla olika funktioner, från hormoner som insulin, till antikroppar i immunsystemet, till strukturella komponenter i celler och vävnader som hemoglobin eller kollagen i huden. Och de började alla med de band som en gång i tiden bildades av en slump inom protoribosomen.
Spola fram några miljarder år. Teorin hade upprätthållits genom beräkningar, deduktioner och dimeriseringsexperiment, där forskarna skapade RNA-dimera konstruktioner, som efterliknade den föreslagna protoribosomen. Men tills nyligen förblev teorins grundsatser, ja, till stor del teoretiska. Nu, i en ny studie ledd av postdoktor Dr Tanaya Bose i Yonaths labb, har forskarna försett den med experimentellt stöd.
Bose och kollegor gav sig i kast med att undersöka om en labbsyntetiserad protoribosom skulle vara tillräckligt stabil för att överleva och utföra sin förmodade bindning, det vill säga de ville ta reda på om den verkligen var kapabel till denna uppgift. Hon och de andra medlemmarna i Yonaths team skapade en design för en potentiell protoribosom genom att analysera de fickliknande strukturerna i hjärtat av flera bakteriella ribosomer. Bose förberedde sedan dessa protoribosomala konstruktioner i en laboratorieskål.
Därefter kom det avgörande steget:att kontrollera om de fickliknande dimerkonstruktionerna kunde skapa bindningar mellan aminosyror. Efter att ha blandat konstruktionerna med en lösning innehållande aktiverade aminosyrasubstrat, såväl som olika salter och andra reagens, utsatte Bose reaktionsprodukterna för ett antal tester, inklusive masspektrometrianalys.
Till teamets förtjusning klarade de syntetiska protoribosomer som skapades i labbet uppgiften. "Peptidbindningsbildning är den mest vitala aktiviteten i alla celler, och vi har visat att det kan ske i en protoribosom", säger Bose.
"Den föreslagna protoribosomen kan vara den saknade länken mellan en RNA-dominerad värld - en som kan ha funnits innan proteiner och DNA dök upp - och liv som är baserat på proteiner och nukleinsyror, som vi känner det idag", säger Bashan.
Forskningen publicerades i Nucleic Acids Research . + Utforska vidare