UC Santa Cruz forskare har upptäckt en peptid i mänskligt RNA som reglerar inflammation och kan ge en ny väg för behandling av sjukdomar som artrit och lupus. Teamet använde en screeningsprocess baserad på det kraftfulla genredigeringsverktyget CRISPR för att belysa ett av de största mysterierna kring vårt RNA – molekylen som ansvarar för att utföra genetisk information som finns i vårt DNA.
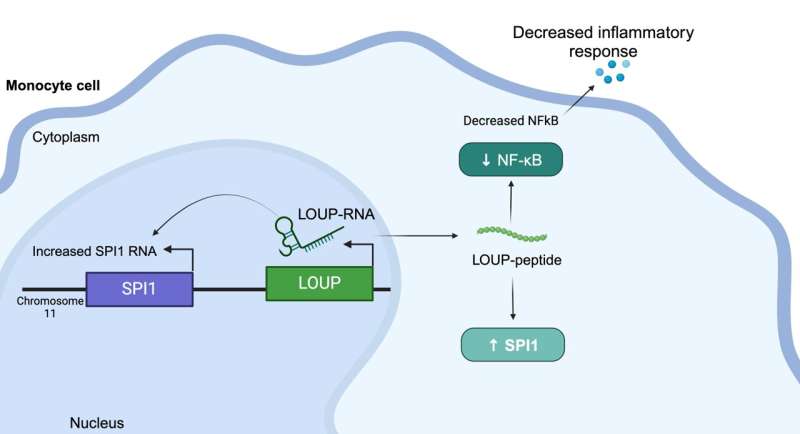
Denna peptid härstammar från ett långt icke-kodande RNA (lncRNA) som kallas LOUP. Enligt forskarna kodar det mänskliga genomet för över 20 000 lncRNA, vilket gör det till den största gruppen gener som produceras från genomet. Men trots detta överflöd vet forskare lite om varför lncRNA finns eller vad de gör. Det är därför som lncRNA ibland kallas "genomets mörka materia."
Studien publicerades den 23 maj i Proceedings of the National Academy of Sciences (PNAS), är en av de mycket få i den befintliga litteraturen som chippar bort lncRNAs mysterier. Den presenterar också en ny strategi för att genomföra screening med hög genomströmning för att snabbt identifiera funktionella lncRNA i immunceller. Den poolade skärmmetoden tillåter forskare att rikta in sig på tusentals gener i ett enda experiment, vilket är ett mycket effektivare sätt att studera okarakteriserade delar av genomet än traditionella experiment som fokuserar på en gen i taget.
Forskningen leddes av immunolog Susan Carpenter, professor och Sinsheimer-ordförande vid UC Santa Cruzs avdelning för molekylär-, cell- och utvecklingsbiologi. Hon studerar de molekylära mekanismer som är involverade i skydd mot infektion. Specifikt fokuserar hon på de processer som leder till inflammation för att bestämma vilken roll lncRNA spelar i dessa vägar.
"Inflammation är ett centralt inslag i nästan varje sjukdom," sa hon. "I den här studien fokuserade mitt labb på att försöka fastställa vilka lncRNA-gener som är involverade i att reglera inflammation."
Detta innebar att man studerade lncRNA i en typ av vita blodkroppar som kallas en monocyt. De använde en modifiering av CRISPR/Cas9-teknologin, kallad CRISPR-inhibition (CRISPRi), för att undertrycka gentranskription och ta reda på vilken av en monocyts lncRNA som spelar en roll för om den differentierar till en makrofag – en annan typ av vita blodkroppar som är avgörande för att ett välfungerande immunsvar.
Dessutom använde forskarna CRISPRi för att screena makrofag-lncRNA för inblandning i inflammation. Oväntat lokaliserade de en region som är multifunktionell och kan fungera som ett RNA såväl som som innehåller en oupptäckt peptid som reglerar inflammation.
Att förstå att denna specifika peptid reglerar inflammation ger läkemedelstillverkare ett mål att blockera den molekylära interaktionen bakom det svaret för att undertrycka det, sa Carpenter. "I en ideal värld skulle du designa en liten molekyl för att störa den specifika interaktionen, istället för att till exempel rikta in dig på ett protein som kan uttryckas i hela kroppen," förklarade hon. "Vi är fortfarande långt ifrån att inrikta oss på dessa vägar med den precisionsnivån, men det är definitivt målet. Det finns ett stort intresse för RNA-terapi just nu."
Medförfattare till studien från UC Santa Cruz inkluderar Haley Halasz, Eric Malekos, Sergio Covarrubias, Samira Yitiz, Christy Montano, Lisa Sudek och Sol Katzman, tillsammans med forskare vid UCSF och MIT.
Mer information: Haley Halasz et al, CRISPRi-skärmar identifierar lncRNA, LOUP, som ett multifunktionellt lokus som reglerar makrofagdifferentiering och inflammatorisk signalering, Proceedings of the National Academy of Sciences (2024). DOI:10.1073/pnas.2322524121
Journalinformation: Proceedings of the National Academy of Sciences
Tillhandahålls av University of California - Santa Cruz