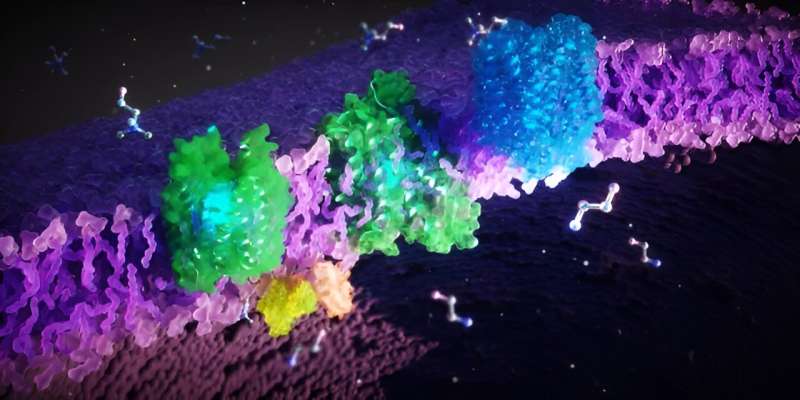
Det är känt att funktionsfel hos proteinerna FLVCR1 och FLVCR2 leder till sällsynta ärftliga sjukdomar hos människor som orsakar motoriska, sensoriska och neurologiska störningar. De biokemiska mekanismerna bakom detta och de fysiologiska funktionerna hos FLVCR-proteinerna har dock hittills varit oklara.
Ett tvärvetenskapligt team av forskare från Frankfurt am Main, Singapore och USA har nu dechiffrerat FLVCR-proteinernas 3D-strukturer och deras cellulära funktioner. Forskarna har visat att proteinerna transporterar de cellulära byggstenarna kolin och etanolamin. Deras resultat bidrar väsentligt till att förstå patogenesen av sällsynta sjukdomar och utveckla nya terapier.
I tv-serier på sjukhus söker läkare efter korrekta diagnoser och möjliga behandlingar för patienter med ibland förbryllande eller konstiga symtom. I verkligheten tar denna process ofta år för dem som drabbats av sällsynta sjukdomar. I många fall finns det ingen effektiv medicin och de terapeutiska alternativen är begränsade.
Cirka 6–8 % av världens befolkning lider av en sällsynt sjukdom. Det är cirka 500 miljoner människor, även om var och en av de mer än 7 000 olika sjukdomarna bara drabbar cirka 1 av 2 000 människor. Eftersom dessa sjukdomar är så sällsynta är den medicinska och vetenskapliga kunskapen om dem begränsad. Det finns bara ett fåtal experter över hela världen och social medvetenhet saknas.
Ett internationellt team av forskare under ledning av Schara Safarian, projektgruppsledare vid Max Planck Institute of Biophysics samt oberoende gruppledare vid Fraunhofer Institute for Translational Medicine and Pharmacology ITMP, och Institute of Clinical Pharmacology vid Goethe University Frankfurt, har nu undersökte strukturen och cellfunktionen hos två proteiner, FLVCR1 och FLVCR2, som spelar en orsaksroll i ett antal sällsynta ärftliga sjukdomar.
Forskarna har publicerat sina fynd i Nature .
Felfunktioner hos FLVCR1 och FLVCR2 på grund av genmutationer orsakar sällsynta sjukdomar, av vilka några resulterar i allvarliga syn-, rörlighets- och sensoriska störningar – såsom posterior kolonnataxi med retinitis pigmentosa, Fowlers syndrom eller sensoriska och autonoma neuropatier. Det senare kan till exempel leda till att smärtkänslan försvinner helt.
"I många sjukdomar, inklusive de sällsynta, förändras cellstrukturerna i vår kropp och detta leder till funktionsfel i biokemiska processer", säger Schara Safarian. "För att förstå utvecklingen av sådana sjukdomar och utveckla terapier måste vi veta hur dessa proteiner är uppbyggda på molekylär nivå och vilka funktioner de utför i friska celler."
Forskarna har upptäckt att FLVCR 1 och FLVCR2 transporterar molekylerna kolin och etanolamin över membranen i våra celler. "Kolin och etanolamin är avgörande för viktiga kroppsfunktioner. De stödjer tillväxten, regenereringen och stabiliteten av våra celler, till exempel i muskler, inre organ och hjärnan", förklarar Safarian.
"Dessutom är kolin involverat i fettmetabolism och avgiftning i levern. Vår kropp behöver det också för att producera signalsubstansen acetylkolin som är avgörande för vårt nervsystem och som behövs av vår hjärna för att kontrollera organen. Så du kan föreställa dig att det fungerar fel. av FLVCR-proteinerna kan orsaka allvarliga neurologiska och muskulära störningar."
Forskarna använde mikroskopiska, biokemiska och datorstödda metoder för att undersöka FLVCR-proteinerna. "Vi chockfryste proteinerna och observerade dem sedan under ett elektronmikroskop", förklarar Di Wu, forskare vid Max Planck Institute of Biophysics och medförfattare till studien. "En elektronstråle penetrerar det frusna provet och interaktionen mellan elektronerna och materialet skapar en bild."
Forskarna tar många individuella bilder och bearbetar och kombinerar dem beräkningsmässigt för att få högupplösta 3D-strukturer av proteiner. På så sätt kunde de dechiffrera strukturerna hos FLVCR1 och FLVCR2 och se hur de förändras i närvaro av etanolamin och kolin. Datorsimuleringar bekräftade och visualiserade hur FLVCR-proteinerna interagerar med etanolamin och kolin och dynamiskt förändrar deras struktur för att möjliggöra näringstransport.
Safarian sammanfattar:"Våra resultat banar väg för att förstå utvecklingen och progressionen av sällsynta sjukdomar associerade med FLVCR-proteinerna. I framtiden kan patienter kanske dra nytta av nya terapier som återställer deras livskvalitet."
Mer information: Keiken Ri et al, Molecular mechanism of choline and ethanolamine transport in humans, Nature (2024). DOI:10.1038/s41586-024-07444-7
Journalinformation: Natur
Tillhandahålls av Max Planck Society