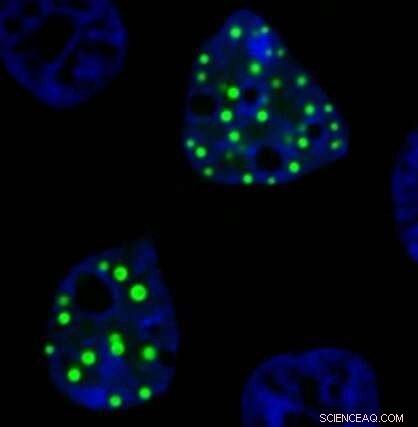
En mikroskopbild visar onkofusionsproteinet FUS-DDIT3 som bildar ektopiska droppar inuti laboratorieodlade levande celler. Dessa proteindroppar visas som en ljusgrön klump, eftersom de är märkta med ett grönt fluorescerande protein. Kredit:Richoo B. Davis
I upptakten till cancer kan genetiska mutationer ibland leda till bildandet av chimära proteiner gjorda av delar av två olika proteiner som vanligtvis är separata.
En ny recensionsartikel undersöker den senaste vetenskapen om en viss klass av dessa cancerkopplade "onkofusionsproteiner", med fokus på de onkofusionsproteiner som kan bilda vätskeliknande droppar som kallas "ektopiska kondensat" i celler.
Artikeln publicerades den 25 april i Trends in Cell Biology av University at Buffalo forskarna Richoo B. Davis, Mahdi Muhammad Moosa och Priya R. Banerjee, alla vid institutionen för fysik vid UB College of Arts and Sciences. Banerjee, Ph.D., är biträdande professor i fysik, och Davis, Ph.D. och Moosa, Ph.D., är postdoktorer i Banerjee Lab.
I laboratorieexperiment uppstår ektopiska kondensat när en del av ett protein som normalt bildar droppar smälts samman med en del av ett annat protein som vanligtvis finns på en annan plats i en cell. Det resulterande chimära proteinet behåller vissa funktioner från båda de ursprungliga proteinerna och kan bilda droppar på "fel" plats inuti cellerna, säger Moosa.
Proteindroppar, även kända som "membranlösa organeller", kan fungera som nav för biokemisk aktivitet, så felplacerade droppar med avvikande funktioner är intressanta att undersöka, säger forskarna.
"En viktig publik för vår recension är cancerforskare," säger Moosa. "Biofysiker som studerar biomolekylära kondensat kanske redan är bekanta med dessa koncept, men vi ville nå ut och dela dessa insikter med cancerbiologiska forskare som direkt arbetar med patientprover."
Davis noterar att ektopiska kondensat kan erbjuda ett attraktivt mål för cancerterapi, men att mer forskning behövs för att bättre förstå hur dessa chimära proteiner fungerar i sitt naturliga tillstånd och hur de kan koppla om gentranskription som leder till cancerutveckling:"Cellen är en mycket komplext system, säger han. "Vi behöver bättre verktyg för att studera proteinkondensat i deras naturliga förhållanden, och våra framtida studier kommer att fokuseras på att ta itu med detta."
I översiktsartikeln sammanfattar författarna nya resultat från flera nyligen publicerade arbeten från olika forskargrupper, inklusive en studie från 2021 som de genomförde tillsammans med Taranpreet Kaur, en nyligen genomförd UB-fysik Ph.D. examen.
Den tidigare artikeln, som visas i ett specialnummer av tidskriften Protein Science om "Biophysics of Biomolecular Condensates", fokuserade på ett FET-familj onkofusionsprotein och fick titeln, "FUS onkofusionsproteinkondensat rekryterar mSWI/SNF-kromatinremodellerare via heterotypiska interaktioner mellan prionliknande domäner." Teamet visade hur dessa ektopiska proteinkondensat kan rekrytera nyckelmolekylära maskiner för att förändra balansen i genreglering.
"Upptäckten av proteinfasseparation har förändrat vår syn på hur celler organiserar sitt inre utrymme", säger Banerjee. "I takt med att mer och mer forskning dyker upp inom detta spännande område lär vi oss om proteindroppars roll i viktiga biologiska processer som genreglering och deras roll i dödliga mänskliga sjukdomar. Baserat på nya data från olika laboratorier misstänker vi att en undergrupp av cancerkopplade fusionsproteiner kan bilda nya typer av kondensat, som normala celler inte har."
"Studien av naturligt förekommande fusionsproteiner och deras kondensat med nya biologiska funktioner är inte bara viktiga ur cancerbiologins perspektiv utan också ur proteinteknikens synvinkel, eftersom att lära sig hur dessa fusionsproteiner fungerar kommer att ge nya möjligheter att skapa artificiella proteiner med nya tillämpningar inom biomedicinska vetenskaper," tillägger Banerjee.